Introduction
Les vasculites à anticorps dirigés contre le cytoplasme des neutrophiles (ANCA) constituent un groupe de maladies auto-immunes responsables d’une inflammation et d’une nécrose des petits vaisseaux (artérioles, capillaires, veinules) associées à la présence d’ANCA (1,2). Les ANCA sont des autoanticorps ciblant les granuloprotéines des neutrophiles, le plus souvent la protéinase leucocytaire 3 (PR3) ou la myéloperoxydase (MPO) (1).
Les vasculites à ANCA affectent principalement les reins et les voies respiratoires, et peuvent virtuellement toucher tous les organes (1,2). Les patients atteints de vasculite à ANCA présentent le plus souvent une maladie sévère mettant en jeu le pronostic vital ou avec un risque de perte irréversible de fonction rénale. On distinguait historiquement trois formes cliniques : la granulomatose avec polyangéite ; la polyangéite microscopique ; et la granulomatose à éosinophiles avec polyangéite. Les deux premières constituent 80-90% des cas et partagent de nombreuses similitudes, au niveau génétique, physiopathologique, clinique et thérapeutique. La granulomatose à éosinophiles avec polyangéite est plus rare et nécessite une prise en charge spécifique – qui ne sera pas abordée dans cette revue. Actuellement, la classification des vasculites à ANCA repose sur la cible antigénique (PR3 vs. MPO) plutôt que sur la présentation clinique (granulomatose avec polyangéite vs. polyangéite microscopique).
Bien que répondant aux définitions des maladies rares, les vasculites à ANCA sont régulièrement rencontrées par de nombreuses disciplines, en médecine spécialisée (e.a. néphrologues, pneumologues, rhumatologues, internistes) et en médecine générale. Leur prévalence est en augmentation, actuellement estimée à 300-400 cas par million d’habitants (1). Cette hausse s’explique probablement par différents facteurs, dont une meilleure définition des cas, une amélioration de la survie grâce aux traitements « modernes » et, possiblement, des modifications liées à l’environnement. L’incidence de ces maladies, rares chez l’enfant, augmente avec l’âge jusqu’à un pic vers 60-70 ans, avec une prédominance dans les populations d’origine européenne (1).
Historiquement, en l’absence de traitement, les vasculites à ANCA étaient associées à une mortalité d’environ 80% à un an (3). Malgré les avancées thérapeutiques récentes, la mortalité reste deux à trois fois plus élevée par rapport à la population générale, en raison des effets combinés de la maladie et de complications infectieuses liées aux traitements (4).
Dans cette revue destinée à l’ensemble de la communauté médicale et aux étudiants en médecine, nous résumons l’état actuel des connaissances et les dernières recommandations de prise en charge sur les vasculites à ANCA. Nous rappelons quand suspecter et comment diagnostiquer cette maladie et discutons les nouvelles modalités de traitement des vasculites à ANCA.
Pathogenèse des vasculites à ANCA
La physiopathologie des vasculites à ANCA est complexe et encore incomplètement élucidée, faisant intervenir facteurs génétiques, environnementaux et immunologiques.
Bien que les vasculites à ANCA ne suivent pas un mode de transmission mendélienne classique, des études ont identifiés plusieurs facteurs de susceptibilité génétique (5). Du point de vue environnemental, l’exposition à des toxiques (silice, hydrocarbures et pesticides) a été associée à la maladie, et le portage nasal de Staphylococcus aureus augmente le risque de récidive chez les patients avec une vasculite à ANCA-PR3 (6).
Au niveau immunologique, l’activation (priming) des neutrophiles par les cytokines, l’action directe des ANCA sur les neutrophiles activés, ainsi que l’activation de la cascade du complément constituent des éléments-clés dans la pathogenèse des vasculites à ANCA. Le rôle pathogène direct des ANCA a été démontré dans des modèles expérimentaux, dans lesquels le transfert des autoanticorps reproduit les lésions et le phénotype de la maladie (7,8). Enfin, des données expérimentales ont montré que le système du complément, un composant central de l’immunité innée, est activé et contribue au développement des lésions tissulaires dans les vasculites à ANCA (9). Comme nous le discuterons plus loin, l’avacopan, un antagoniste du récepteur C5a, a été développé sur cette base et constitue une avancée importante pour le traitement des vasculites à ANCA.
Comment établir un diagnostic précoce de vasculite à ANCA ?
Le diagnostic de vasculite à ANCA reste difficile et le retard diagnostique est fréquent, avec un délai médian de 6 mois entre l’apparition des symptômes et le diagnostic (10). Le diagnostic repose sur un ensemble d’éléments cliniques, sérologiques, iconographiques, histologiques.
Devant quels symptômes cliniques évoquer le diagnostic ?
Les patients atteints de vasculite à ANCA présentent généralement des symptômes généraux aspécifiques (fatigue, fièvre, myalgies, perte pondérale, syndrome inflammatoire, anémie secondaire) qui peuvent persister plusieurs mois avant que des lésions d’organes n’apparaissent. Les atteintes d’organes sont variées, avec une prédilection pour les reins et les voies respiratoires (Tableau 1).
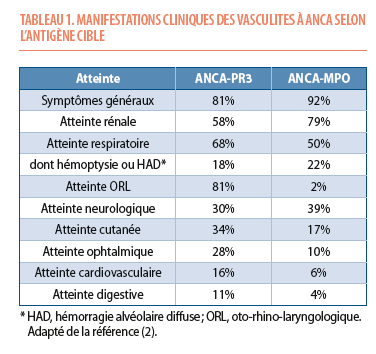
L’atteinte rénale est présente chez 60 à 80% des patients (2). Le tableau consiste typiquement en une glomérulonéphrite rapidement progressive, caractérisée par une insuffisance rénale qui évolue généralement en quelques jours ou semaines ; une protéinurie d’abondance modérée, composée essentiellement d’albumine ; une hématurie microscopique glomérulaire (cylindres hématiques et/ou globules rouges dysmorphiques) ; et le plus souvent une hypertension artérielle. Il convient devant toute élévation inexpliquée de la créatinine de réaliser un sédiment urinaire et un dosage de la protéinurie. Un échantillon urinaire simple, avec dosage concomitant des protéines, idéalement de l’albumine, et de la créatinine, suffit. Il n’est plus recommandé de recourir systématiquement à une collecte urinaire de 24 heures, laborieuse et souvent imprécise. L’atteinte rénale est le principal facteur prédictif de mortalité, avec un risque de décès ou d’insuffisance rénale à 5 ans de 50% en cas d’altération de la fonction rénale au diagnostic (6).
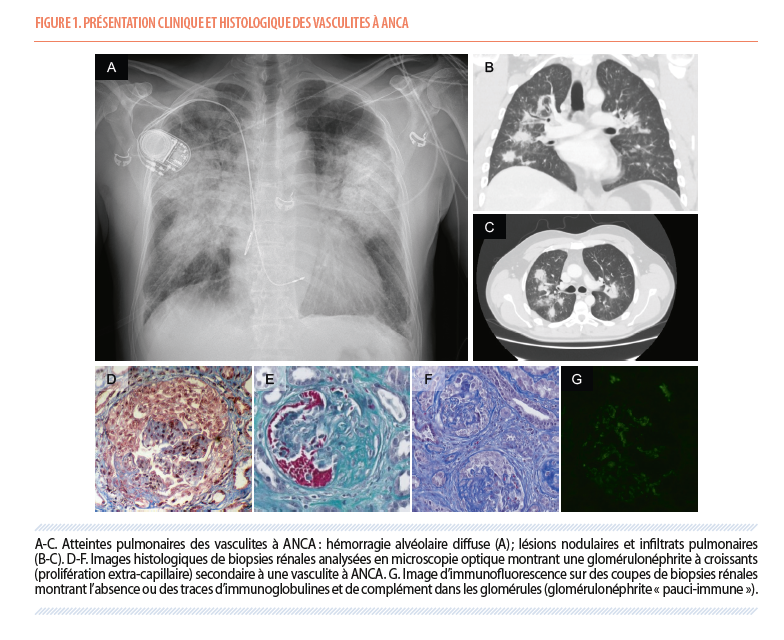
Les poumons sont également fréquemment touchés par la maladie, et les patients peuvent présenter des hémoptysies, de la dyspnée ou une toux prolongée. L’imagerie thoracique peut révéler une hémorragie alvéolaire, parfois diffuse, et des lésions nodulaires voire caverneuses (Figure 1). Un tableau de « pneumonie » qui évolue défavorablement malgré une antibiothérapie adéquate doit aussi faire évoquer le diagnostic, a fortiori en présence de symptômes systémiques. L’atteinte des voies respiratoires supérieures peut causer une rhinite chronique, des lésions des sinus, de l’oreille moyenne ou du septum nasal.
Les vasculites à ANCA peuvent également entraîner une atteinte oculaire (sclérite, uvéite) ; des lésions cutanées (purpura, lésions nécrotiques, nodules cutanés) ; des lésions neurologiques (mononévrite multiple) ; et, plus rarement, une atteinte digestive (vasculite mésentérique, hépatite, pancréatite) ou cardiaque (myocardite ou bloc de conduction auriculo-ventriculaire). Enfin, des thromboses veineuses sont fréquentes et peuvent survenir pendant la phase active de la vasculite (6).
Confirmation diagnostique de vasculite à ANCA
La confirmation diagnostique doit être réalisée en urgence et repose sur deux examens-clés : la détection sérologique d’ANCA dirigés contre PR3 ou MPO et la biopsie d’un organe atteint, le plus souvent le rein.
La mise en évidence des ANCA dans le sérum est cruciale pour le diagnostic. La méthode enzymatique, qui distingue les ANCA dirigés contre la MPO des ANCA dirigés contre la PR3, constitue la méthode de référence et doit être réalisée en urgence chez tout patient chez qui le diagnostic est évoqué. Les tests d’immunofluorescence, qui détectent un profil périnucléaire (p-ANCA) ou cytoplasmique (c-ANCA), ont une valeur prédictive plus faible que la méthode enzymatique et ne doivent plus être utilisés (11).
À côté des ANCA, il faut également rechercher la présence d’anticorps anti-membrane basale glomérulaire, présents chez environ 10% des patients avec une vasculite à ANCA (12). Les patients avec une double positivité ont une maladie plus sévère avec une mortalité précoce similaire à celles des patients atteints de maladie à anticorps anti-membrane basale glomérulaire et une évolution à long terme comparable à celle des vasculites à ANCA, avec un risque de rechutes et de progression vers l’insuffisance rénale.
Enfin, la recherche d’ANCA peut s’avérer négative chez environ 10% des patients avec une présentation clinique et histologique typique de vasculite à ANCA. Bien que l’évolution clinique et la réponse au traitement soient similaires, l’atteinte est plus souvent limitée au rein avec une atteinte systémique moindre (6).
Le rôle de la biopsie rénale est central dans le diagnostic de vasculite à ANCA. En microscopie optique, on observe typiquement une glomérulonéphrite nécrosante avec croissants, des structures constituées de cellules inflammatoires et de fibrine, qui se développent dans la chambre urinaire des glomérules (Figure 1). En immunofluorescence, la glomérulonéphrite est qualifiée de « pauci-immune », c’est à dire caractérisée par l’absence de dépôts d’immunoglobulines ou de complément ou des dépôts de faible intensité lorsqu’ils sont présents. Le caractère pauci-immun distingue les vasculites à ANCA d’autres glomérulonéphrites rapidement progressives, comme les glomérulonéphrites à anticorps anti-membrane basale glomérulaire (dépôts linéaires d’immunoglobulines G) et les maladies à complexes immuns (dépôts granuleux d’immunoglobulines et de complément), comme par exemple la néphrite lupique ou les glomérulonéphrites para-infectieuses. Classiquement, les formes associées aux ANCA-MPO sont plus insidieuses, moins symptomatiques, de diagnostic plus tardif, et plus fréquemment caractérisées par des lésions rénales chroniques irréversibles, avec des lésions de glomérulosclérose et/ou de fibrose interstitielle que celles associées aux ANCA-PR3. Dans de rares cas, une néphrite interstitielle, sans atteinte glomérulaire, peut être observée (6).
La biopsie rénale est également utile à titre pronostique, informant sur le potentiel de récupération rénale et guidant le clinicien dans le choix et l’adaptation des traitements (13-15).
Diagnostic différentiel et formes « secondaires » de vasculites à ANCA
Certaines formes de vasculite à ANCA sont secondaires à des médicaments, la consommation de drogues ou à des infections.
Certains médicaments, généralement après une exposition prolongée, peuvent induire un tableau de vasculite à ANCA, volontiers associée à une double positivité des ANCA (PR3-ANCA et MPO-ANCA) et/ou à la présence d’autres autoanticorps tels que des anticorps antinucléaires (16,17). Les médicaments les plus fréquemment incriminés sont l’hydralazine, le propylthiouracile et les inhibiteurs du tumor necrosis factor (anti-TNF). La vasculite à ANCA induite par la cocaïne coupée au lévamisole est caractérisée par des lésions cutanées nécrotiques et par une double positivité PR3-ANCA et MPO-ANCA (18).
Des infections (endocardite infectieuse, tuberculose, virus de l’immunodéficience humaine, hépatite C, infection à Bartonella henselae), les maladies inflammatoires chroniques de l’intestin, et certaines tumeurs malignes peuvent aussi être associées à une sérologie positive pour les ANCA (2). Environ 8% des patients atteints d’endocardite infectieuse présentent une sérologie PR3-ANCA ou MPO-ANCA positive, parfois en titres élevés (19). L’endocardite à Bartonella, une cause fréquente d’endocardite à hémocultures négatives, mime volontiers une vasculite à ANCA. Il faut y songer devant un tableau de vasculite à ANCA-PR3 associé à des anomalies hématologiques (thrombopénie, pancytopénie), une splénomégalie et/ou des dépôts de complément C3 et/ou d’immunoglobulines à la biopsie rénale (20). L’identification rapide de l’infection à Bartonella est cruciale pour débuter un traitement antibiotique adapté et prévenir les complications graves.
Traitement des vasculites à ANCA avec atteinte rénale
Devant une présentation clinique évocatrice de vasculite des petits vaisseaux associée à une sérologie MPO ou PR3-ANCA positive, un traitement immunosuppresseur doit rapidement être initié, sans attendre la réalisation ou les résultats d’une biopsie rénale, a fortiori lorsque le pronostic vital est engagé ou en cas de détérioration clinique rapide. Dans les prochains paragraphes, nous résumons les recommandations récentes issues des Kidney Disease : Improving Global Outcomes (21) et de l’European Alliance of Associations for Rheumatology (22), en nous focalisant sur les formes avec une atteinte rénale, qui sont les plus fréquentes et les plus graves. Le traitement se divise en deux phases. Une première phase d’induction durant les 3 à 6 premiers mois vise à interrompre le processus inflammatoire, et est suivie par une phase de maintenance de la rémission. Nous discutons également dans ce paragraphe la place de l’avacopan comme alternative aux stéroïdes ; la place des échanges plasmatiques ; et les modalités de prévention des infections opportunistes chez des patients bénéficiant d’un traitement immunosuppresseur.
Traitement d’induction : que disent les recommandations ?
En raison de la sévérité de la maladie et de la lourdeur des traitements, les patients atteints de vasculite à ANCA doivent être traités dans des centres ayant l’expertise pour la prise en charge de ces maladies (21,22).
Pour les patients avec une atteinte rénale, le traitement d’induction est basé sur l’utilisation de rituximab ou de cyclophosphamide en association avec des glucocorticoïdes (Figure 2). Pour les formes engageant le pronostic vital et/ou avec une atteinte rénale sévère (créatinine sérique >3.4 mg/dl), le cyclophosphamide, éventuellement associé au rituximab, sera préféré. Les posologies et schémas d’administration recommandés sont repris dans le Tableau 2.
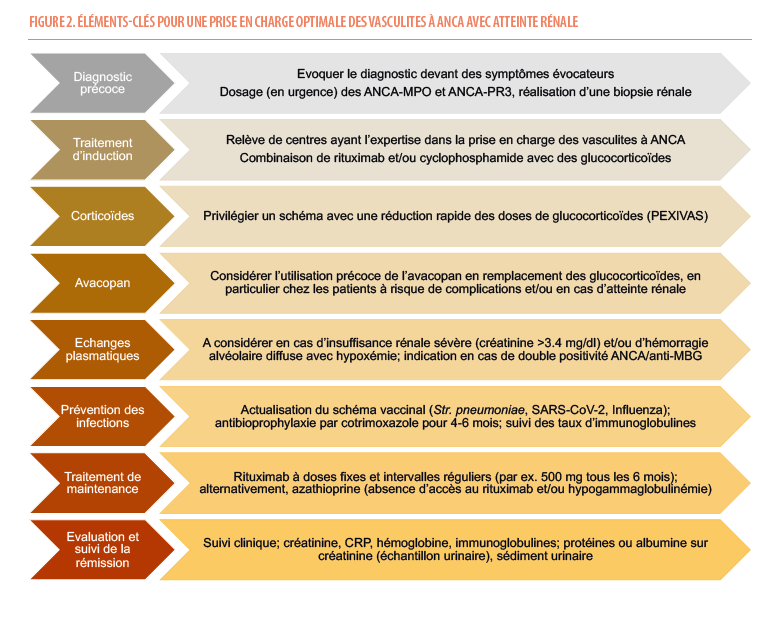
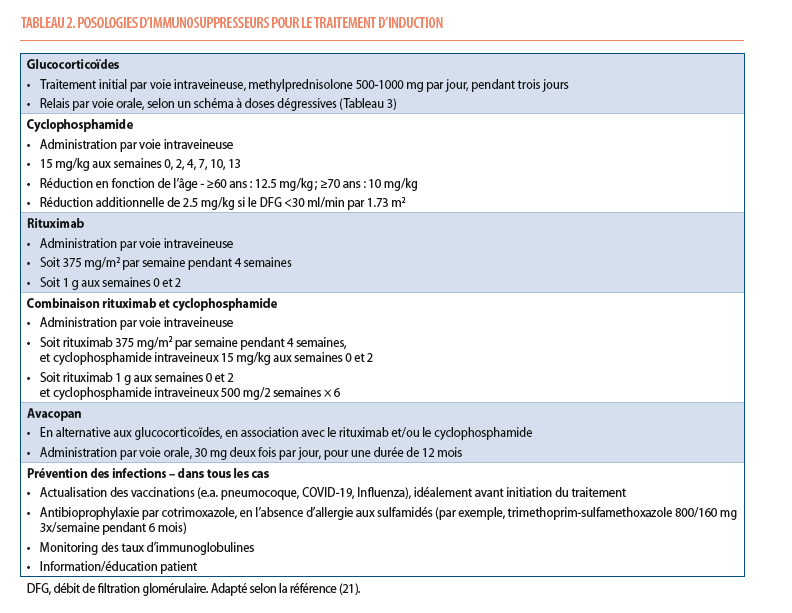
Le cyclophosphamide est un agent alkylant qui a radicalement modifié le devenir des patients atteints de vasculite à ANCA. Compte-tenu d’une efficacité similaire et d’une une toxicité réduite par rapport à la forme orale, l’administration intraveineuse est privilégiée dans la majorité des cas (23). En raison de sa toxicité hématologique, sur la fertilité et du risque de néoplasie secondaire, le cyclophosphamide est actuellement réservé aux formes sévères ou rapidement progressives.
Le rituximab est un anticorps monoclonal anti-CD20 ciblant et déplètant les lymphocytes B producteurs d’auto-anticorps. Les études RAVE et RITUXVAS ont montré que le rituximab était non-inférieur au cyclophosphamide – en association avec les corticostéroïdes – pour induire la rémission chez les patients atteints de vasculite à ANCA. Le rituximab s’est même avéré supérieur au cyclophosphamide dans les formes à risque élevé de rechute, comme les patients atteints de vasculite à ANCA-PR3 (24,25).Le rituximab est à privilégier chez la majorité des patients et en particulier chez les patients jeunes, les maladies récidivantes, une maladie à ANCA-PR3 ou dans les cas où l’épargne cortisonique est particulièrement importante (notamment les patients âgés et fragiles).
Le traitement combinant rituximab et cyclophosphamide est indiqué dans les atteintes les plus sévères, en cas de maladie réfractaire ou de réponse lente au traitement (26).
L’obtention d’une rémission clinique et son maintien dans le temps sont évalués sur base d’une série d’éléments incluant l’état clinique (état général et atteintes d’organes) ; le taux de créatinine sérique/débit de filtration glomérulaire ; la protéinurie (rapport protéines ou albumine sur créatinine sur un échantillon urinaire) ; la présence d’une hématurie (sédiment urinaire) ; la présence d’un syndrome inflammatoire biologique (protéine C-réactive), le taux d’hémoglobine ; et le titre des ANCA. L’évolution de ces paramètres dans le temps, plus que leur valeur absolue prise isolément, est déterminante pour apprécier la réponse au traitement. Ces paramètres sont repris dans l’échelle de la Birmingham Vasculitis Activity Score (version 3), également utilisée dans le cadre des études cliniques (27).
La rémission est le plus souvent obtenue après 3 à 6 mois de traitement d’induction. Cependant, en l’absence de traitement de maintenance, la maladie récidive chez la plupart des patients. Le risque de rechute est notamment plus élevé chez les patients ayant une positivité PR3-ANCA et/ou une atteinte extra-rénale.
Quel traitement de maintenance pour les vasculites à ANCA ?
Après l’obtention d’une rémission, les KDIGO 2024 et les recommandations EULAR recommandent un traitement d’entretien par rituximab, alternativement par azathioprine, en association avec une faible dose de glucocorticoïdes (21,22).
Le rituximab sera préféré dans la majorité des cas, et certainement face à une maladie récidivante, une maladie associée aux ANCA-PR3 et chez les patients âgés fragiles. Une dose fixe de rituximab de 500 à 1000 mg est administrée tous les 6 mois, sur base de deux essais contrôlés randomisés, MAINRITSAN1 (28) et RITAZAREM (29). L’essai MAINRITSAN1 a montré que le rituximab (500 mg tous les 6 mois) était plus efficace que l’azathioprine pour prévenir les rechutes majeures après un traitement d’induction par cyclophosphamide, avec un taux de rechutes de 5% contre 29%, respectivement, à 28 mois, tout en ayant un profil de sécurité comparable. L’essai RITAZAREM a montré que la poursuite du rituximab (1000 mg tous les 4 mois) était plus efficace que le traitement par azathioprine pour le maintien de la rémission après un traitement d’induction par rituximab avec des taux de rechute de respectivement 15% et 38% après 36 mois de suivi. Dans cette étude, les évènements indésirables graves étaient moins fréquents chez les patients restant sous rituximab.
L’azathioprine peut être envisagée comme alternative lorsque le rituximab n’est pas disponible ou en cas d’hypogammaglobulinémie marquée avant traitement (immunoglobulines G <3 g/L).
La durée optimale du traitement de maintenance n’est pas établie. L’étude MAINRITSAN3 a montré qu’il doit être poursuivi au minimum 18 à 48 mois après l’induction de la rémission (30), peut-être plus dans les formes à haut risque de récidive.
Réduction rapide des doses des glucocorticoïdes
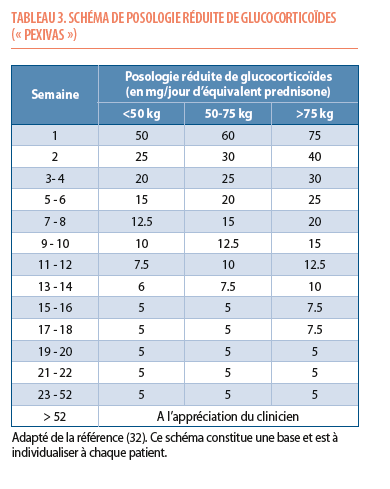
Les glucocorticoïdes ont un effet anti-inflammatoire puissant et rapide mais sont associés, sur le long-terme, à des effets secondaires majeurs incluant diabète secondaire, ostéoporose, prise pondérale et complications infectieuses. Dans les vasculites à ANCA, à l’instar de nombreuses maladies autoimmunes, des efforts doivent limiter l’exposition aux stéroïdes et diminuer leurs effets secondaires (31,32). L’étude PEXIVAS a montré que, comparativement aux schémas standards, l’utilisation d’une diminution rapide des doses de glucocorticoïdes (Tableau 3) réduit substantiellement les complications infectieuses graves – sans perdre en efficacité sur le taux de rémission (32). Sur base de ces données, le schéma posologique de glucocorticoïdes utilisé dans PEXIVAS est actuellement recommandé pour la plupart des patients avec une vasculite à ANCA (Tableau 3).
Place de l’avacopan dans la prise en charge des vasculites à ANCA
Malgré les traitements à base de glucocorticoïdes et de cyclophosphamide ou de rituximab, les patients avec une vasculite à ANCA gardent un risque important de décès durant la première année après le diagnostic, en raison notamment de complications liées au traitement immunosuppresseur, en particulier les glucocorticoïdes.
L’avacopan est un inhibiteur sélectif du récepteur C5a administré par voie orale qui a démontré son efficacité comme traitement alternatif aux stéroïdes dans le traitement des vasculites à ANCA. La fraction C5a du complément et son récepteur (récepteur au C5a ou CD88) jouent un rôle central dans la pathogenèse de la vasculite à ANCA, activant les neutrophiles, causant leur dégranulation et entraînant un puissant effet pro-inflammatoire et pro-coagulant (33). L’avacopan est un antagoniste du récepteur au C5a capable de bloquer le développement de la glomérulonéphrite induite par les ANCA-MPO dans des modèles expérimentaux de vasculite à ANCA (34,35).
L’efficacité et la tolérance de l’avacopan ont été évaluées dans l’étude de phase 3 ADVOCATE (36,37). Dans cet essai randomisé et contrôlé, 331 patients avec vasculite à ANCA ont reçu de l’avacopan (à la dose de 30 mg deux fois par jour) ou un schéma dégressif de prednisone, en association avec un traitement d’induction par rituximab ou cyclophosphamide. A 6 mois, l’avacopan a montré une efficacité similaire à celle de la prednisone, avec une rémission obtenue chez 72% des patients recevant l’avacopan vs. 70% des patients du groupe prednisone (P<0.001 pour la non-infériorité). A 12 mois, l’avacopan s’est même montré plus efficace que les corticoïdes pour l’obtention et le maintien d’une rémission durable, avec un taux de rémission obtenu chez 66% et 55% des patients, respectivement (P<0.001 pour la non-infériorité ; P=0.007 pour la supériorité). Le nombre d’événements indésirables graves était plus important dans le groupe prednisone (+33%) que dans le groupe avacopan ; il y a notamment eu plus de décès, d’événements mettant en jeu le pronostic vital et d’infections dans le groupe prednisone. Aucun cas d’infection à méningocoque n’a été observé durant l’étude.
Durant l’étude ADVOCATE, le débit de filtration glomérulaire estimé (DFGe) a augmenté en moyenne de 7.3 ml/min dans le groupe avacopan et de 4.1 ml/min dans le groupe prednisone (P=0.029), suggérant un bénéfice rénal additionnel conféré par l’inhibiteur du récepteur au C5a (37). Les effets bénéfiques de l’avacopan sur la récupération rénale sont également supportés par l’analyse du sous-groupe de patients avec une altération sévère de la fonction rénale à l’inclusion dans ADVOCATE (DFGe ≤20 ml/min) (38). Dans cette population, le DFGe a augmenté en moyenne de 16.1 vs. 7.7 ml/min (P=0.003), et un doublement de la valeur de DFG a été observé chez 41% vs. 13% (P=0.03) dans les groupes avacopan et prednisone, respectivement (38).
Des analyses post hoc d’ADVOCATE ont montré que l’épargne cortisonique significative permise grâce à l’avacopan (réduction de l’exposition de >2000 mg de prednisone sur 12 mois) était associée à une diminution du score de toxicité des stéroïdes et à une amélioration de la qualité de vie (39,40).
Les résultats d’ADVOCATE ont été confirmés par des données « de vie réelle » (post-marketing) (41).Dans une série rétrospective de 92 patients avec vasculite à ANCA traités par avacopan, la rémission clinique a été obtenue chez 90% des patients à 6 mois et chez 84% à 12 mois. Cette étude a également montré les bénéfices de cette molécule dans des populations exclues d’ADVOCATE, notamment chez les patients avec un DFGe <15 ml/min ou la nécessité de dialyse, et chez ceux ayant été traités par échanges plasmatiques (41).
Bien que l’avacopan ait été approuvé par l’Agence Européenne des Médicaments, il n’est actuellement pas remboursé en Belgique et n’est disponible que dans le cadre d’un usage compassionnel. En pratique, le traitement par avacopan peut être utile lorsque les glucocorticoïdes sont contre-indiqués ou présentent un risque élevé de toxicité, chez les patients ayant une fonction rénale réduite ou une maladie réfractaire. La posologie de l’avacopan est de 30 mg, soit 3 capsules de 10 mg, en deux prises par jour. Aucun ajustement de dose n’est nécessaire pour les patients âgés, avec une insuffisance hépatique modérée ou une insuffisance rénale (42). Après l’initiation de l’avacopan, la posologie de glucocorticoïdes est en général diminuée de manière progressive, avec un arrêt après 4 semaines. La tolérance de l’avacopan est excellente et les effets indésirables les plus fréquents incluent des nausées, des céphalées ou une leucopénie transitoire. Des anomalies des tests hépatiques ont été observées chez ~5% des patients, et un suivi biologique régulier (enzymes hépatiques et globules blancs) est recommandé. L’avacopan étant métabolisé par le cytochrome CYP3A4, il convient d’être attentif au risque d’interactions médicamenteuses et une réduction transitoire de la posologie d’avacopan peut être nécessaire en cas d’utilisation concomitante d’un inhibiteur du CYP3A4. Sur base des données actuelles, le traitement par avacopan est conduit pour une durée maximale de 12 mois. Son utilisation est contre-indiquée en cas d’insuffisance hépatique sévère, d’infection chronique active, ainsi que chez les enfants, les femmes enceintes ou allaitantes. Une antibioprophylaxie est recommandée, à l’instar de tous les patients recevant un traitement d’induction (vide infra).
Place des échanges plasmatiques dans les vasculites à ANCA
L’intérêt des échanges plasmatiques dans la prise en charge des vasculites à ANCA reste débattu. En dépit d’un design suboptimal, l’étude historique MEPEX (43) avait suggéré un bénéfice des échanges plasmatiques sur la progression vers l’insuffisance rénale à un an, comparativement à de hautes doses de méthylprednisolone. En revanche, l’étude PEXIVAS, plus récente, avec un design plus robuste et un grand nombre de participants (n=704), n’est pas parvenue à confirmer le bénéfice des échanges plasmatiques en termes de mortalité ou de progression vers l’insuffisance rénale après 3 ans de suivi (32). Une analyse post-hoc de PEXIVAS a toutefois suggéré que les patients traités par échanges plasmatiques présentent une amélioration significative du débit de filtration glomérulaire à 4 semaines et à 12 mois, comparativement à ceux qui n’en ont pas reçu (44). Une méta-analyse des données disponibles conclut que les échanges plasmatiques pourraient diminuer la progression vers l’insuffisance rénale et le besoin de dialyse à un an chez les patients avec une insuffisance rénale sévère au diagnostic (créatinine ≥3.4 mg/dL), au prix d’un risque accru d’infections (45).
Au final, les KDIGO suggèrent de « considérer » les échanges plasmatiques chez les patients avec un taux de créatinine sérique élevé (≥ 3.4 mg/dL) au diagnostic ; en cas d’augmentation rapide de la créatinine ou de besoin de dialyse ; et chez les patients avec une hémorragie alvéolaire diffuse compliquée d’hypoxémie. La présence d’anticorps anti-membrane basale glomérulaire associée à une vasculite à ANCA constitue, à ce jour, une indication formelle d’échanges plasmatiques (21).
Prévention des complications infectieuses
En raison du risque infectieux lié aux immunosuppresseurs, la prévention des infections est essentielle chez les patients atteints de vasculite à ANCA. Avant le traitement, il faut exclure toute infection méconnue, notamment l’hépatite B et la tuberculose latente, en adaptant le dépistage au profil épidémiologique du patient.
La mise à jour du calendrier vaccinal doit idéalement être faite avant l’initiation du traitement immunosuppresseur, en tenant compte de la diminution de la réponse vaccinale après rituximab (46) et de la contre-indication des vaccins vivants. Les vaccins recommandés incluent le rappel diphtérie-tétanos-coqueluche, le pneumocoque, la grippe, le SARS-CoV-2, et selon les cas, ceux contre les hépatites A et B, la rougeole, la varicelle/zona, les méningites, le human papilloma virus et la fièvre jaune. Une consultation infectiologique peut être utile (47-49).
Pendant le traitement d’induction, une prophylaxie par triméthoprime-sulfaméthoxazole est indiquée afin de prévenir les infections à) Pneumocystis jirovecii (50); en cas d’allergie aux sulfamidés, des alternatives comme l’atovaquone ou la pentamidine peuvent être utilisées (51).
Enfin, un suivi du taux sérique d’immunoglobulines est impératif, surtout pour les patients sous rituximab, et une supplémentation en gammaglobulines peut être envisagée en cas d’hypogammaglobulinémie avec infections récidivantes (52).
Conclusions et perspectives
La prise en charge des vasculites à ANCA a considérablement évolué au cours des deux dernières décennies, grâce à un diagnostic plus précoce et à des traitements standardisés, plus ciblés et moins toxiques.
Les avancées attendues dans la prise en charge des vasculites à ANCA incluent l’optimisation du traitement d’induction pour les maladies rénales sévères, la détermination de la durée du traitement d’entretien, l’identification de biomarqueurs fiables pour évaluer l’activité subclinique de la maladie et les risques de récidives, et l’évaluation des résultats à long terme après traitement d’induction par l’avacopan et sa place dans le traitement d’entretien.
Parmi les stratégies thérapeutiques prometteuses figurent l’obinutuzumab, un anticorps monoclonal anti-CD20 plus puissant que le rituximab, ainsi que de nouveaux anticorps monoclonaux ciblant le CD19. Les thérapies CAR-T dirigées contre le CD19 sont également à l’étude, en particulier dans les cas réfractaires. D’autres approches visant à moduler les cellules B plutôt qu’à les dépléter, ainsi que des stratégies pour inhiber les voies du complément représentent également des pistes thérapeutiques intéressantes.
Références
-
Kitching AR, Anders HJ, Basu N et al. ANCA-associated vasculitis. Nat Rev Dis Primers. 2020 Aug 27;6(1):71. doi: 10.1038/s41572-020-0204-y.
-
Kronbichler A, Bajema IM, Bruchfeld A, Mastroianni Kirsztajn G, Stone JH. Diagnosis and management of ANCA-associated vasculitis. Lancet. 2024 Feb 17;403(10427):683-698. doi: 10.1016/S0140-6736(23)01736-1.
-
Walton EW. Giant-cell granuloma of the respiratory tract (Wegener’s granulomatosis). Br Med J. 1958 Aug 2;2(5091):265-70. doi: 10.1136/bmj.2.5091.265.
-
Flossmann O, Berden A, de Groot K, et al. Long-term patient survival in ANCA-associated vasculitis. Ann Rheum Dis. 2011 Mar;70(3):488-94. doi: 10.1136/ard.2010.137778.
-
Lyons PA, Rayner TF, Trivedi S, et al. Genetically distinct subsets within ANCA-associated vasculitis. N Engl J Med. 2012 Jul 19;367(3):214-23. doi: 10.1056/NEJMoa1108735.
-
Geetha D, Jefferson JA. ANCA-Associated Vasculitis: Core Curriculum 2020. Am J Kidney Dis. 2020 Jan;75(1):124-137. doi: 10.1053/j.ajkd.2019.04.031.
-
Xiao H, Heeringa P, Hu P, et al. Antineutrophil cytoplasmic autoantibodies specific for myeloperoxidase cause glomerulonephritis and vasculitis in mice. J Clin Invest. 2002 Oct;110(7):955-63. doi: 10.1172/JCI15918.
-
Hutton HL, Holdsworth SR, Kitching AR. ANCA-Associated Vasculitis: Pathogenesis, Models, and Preclinical Testing. Semin Nephrol. 2017 Sep;37(5):418-435. doi: 10.1016/j.semnephrol.2017.05.016.
-
Tesar V, Hruskova Z. Complement Inhibition in ANCA-Associated Vasculitis. Front Immunol. 2022 Jul 8;13:888816. doi: 10.3389/fimmu.2022.888816.
-
Sreih AG, Cronin K, Shaw DG, et al. Diagnostic delays in vasculitis and factors associated with time to diagnosis. Orphanet J Rare Dis. 2021 Apr 21;16(1):184. doi: 10.1186/s13023-021-01794-5.
-
Damoiseaux J, Csernok E, Rasmussen N, et al. Detection of antineutrophil cytoplasmic antibodies (ANCAs): a multicentre European Vasculitis Study Group (EUVAS) evaluation of the value of indirect immunofluorescence (IIF) versus antigen-specific immunoassays. Ann Rheum Dis. 2017 Apr;76(4):647-653. doi: 10.1136/annrheumdis-2016-210755.
-
McAdoo SP, Tanna A, Hrušková Z, et al. Patients double-seropositive for ANCA and anti-GBM antibodies have varied renal survival, frequency of relapse, and outcomes compared to single-seropositive patients. Kidney Int. 2017 Sep;92(3):693-702. doi: 10.1016/j.kint.2017.03.014.
-
Berden AE, Ferrario F, Hagen EC, et al. Histopathologic classification of ANCA-associated glomerulonephritis. J Am Soc Nephrol. 2010 Oct;21(10):1628-36. doi: 10.1681/ASN.2010050477.
-
Brix SR, Noriega M, Tennstedt P, et al. Development and validation of a renal risk score in ANCA-associated glomerulonephritis. Kidney Int. 2018 Dec;94(6):1177-1188. doi: 10.1016/j.kint.2018.07.020.
-
Bate S, McGovern D, Costigliolo F, et al. The Improved Kidney Risk Score in ANCA-Associated Vasculitis for Clinical Practice and Trials. J Am Soc Nephrol. 2024 Mar 1;35(3):335-346. doi: 10.1681/ASN.0000000000000274.
-
Santoriello D, Bomback AS, Kudose S, et al. Anti-neutrophil cytoplasmic antibody associated glomerulonephritis complicating treatment with hydralazine. Kidney Int. 2021 Aug;100(2):440-446. doi: 10.1016/j.kint.2021.03.029.
-
Guchelaar NAD, Waling MM, Adhin AA, et al. The value of anti-neutrophil cytoplasmic antibodies (ANCA) testing for the diagnosis of ANCA-associated vasculitis, a systematic review and meta-analysis. Autoimmun Rev. 2021 Jan;20(1):102716. doi: 10.1016/j.autrev.2020.102716.
-
Collister D, Sathianathan C, Ryz K, et al. ANCA Associated Vasculitis Secondary to Levamisole-Adultered Cocaine with Associated Membranous Nephropathy: A Case Series. Am J Nephrol. 2017;45(3):209-216. doi: 10.1159/000456553.
-
Mahr A, Batteux F, Tubiana S, et al. Brief report: prevalence of antineutrophil cytoplasmic antibodies in infective endocarditis. Arthritis Rheumatol. 2014 Jun;66(6):1672-7. doi: 10.1002/art.38389.
-
Andeen NK, Kung VL, Nguyen JK, et al. Bartonella Endocarditis-Associated Glomerulonephritis: A Mimicker of Autoimmunity and Vasculitis. Kidney International Reports 2025, in press. https://doi.org/10.1016/j.ekir.2025.01.009.
-
Kidney Disease: Improving Global Outcomes (KDIGO) ANCA Vasculitis Work Group. KDIGO 2024 Clinical Practice Guideline for the Management of Antineutrophil Cytoplasmic Antibody (ANCA)-Associated Vasculitis. Kidney Int. 2024 Mar;105(3S):S71-S116. doi: 10.1016/j.kint.2023.10.008.
-
Hellmich B, Sanchez-Alamo B, Schirmer JH, et al. EULAR recommendations for the management of ANCA-associated vasculitis: 2022 update. Ann Rheum Dis. 2024 Jan 2;83(1):30-47. doi: 10.1136/ard-2022-223764.
-
de Groot K, Harper L, Jayne DR, et al. Pulse versus daily oral cyclophosphamide for induction of remission in antineutrophil cytoplasmic antibody-associated vasculitis: a randomized trial. Ann Intern Med. 2009 May 19;150(10):670-80. doi: 10.7326/0003-4819-150-10-200905190-00004.
-
Stone JH, Merkel PA, Spiera R, et al. Rituximab versus cyclophosphamide for ANCA-associated vasculitis. N Engl J Med. 2010 Jul 15;363(3):221-32. doi: 10.1056/NEJMoa0909905.
-
Jones RB, Tervaert JW, Hauser T, et al. Rituximab versus cyclophosphamide in ANCA-associated renal vasculitis. N Engl J Med. 2010 Jul 15;363(3):211-20. doi: 10.1056/NEJMoa0909169.
-
Chalkia A, Jayne D. ANCA-associated vasculitis-treatment standard. Nephrol Dial Transplant. 2024 May 31;39(6):944-955. doi: 10.1093/ndt/gfad237.
-
Mukhtyar C, Lee R, Brown D, et al. Modification and validation of the Birmingham Vasculitis Activity Score (version 3). Ann Rheum Dis. 2009 Dec;68(12):1827-32. doi: 10.1136/ard.2008.101279.
-
Guillevin L, Pagnoux C, Karras A, et al. Rituximab versus azathioprine for maintenance in ANCA-associated vasculitis. N Engl J Med. 2014 Nov 6;371(19):1771-80. doi: 10.1056/NEJMoa1404231.
-
Smith RM, Jones RB, Specks U, et al. Rituximab versus azathioprine for maintenance of remission for patients with ANCA-associated vasculitis and relapsing disease: an international randomised controlled trial. Ann Rheum Dis. 2023 Jul;82(7):937-944. doi: 10.1136/ard-2022-223559.
-
Charles P, Perrodeau É, Samson M, et al. Long-term rituximab use to maintain remission of antineutrophil cytoplasmic antibody-associated vasculitis: a randomized trial. Ann Intern Med. 2020 Jul 7;173(2):179-187. doi: 10.7326/M20-0020.
-
Furuta S, Nakagomi D, Kobayashi Y, et al. Effect of Reduced-Dose vs High-Dose Glucocorticoids Added to Rituximab on Remission Induction in ANCA-Associated Vasculitis: A Randomized Clinical Trial. JAMA. 2021 Jun 1;325(21):2178-2187. doi: 10.1001/jama.2021.6615.
-
Walsh M, Merkel PA, Peh CA, et al. Plasma Exchange and Glucocorticoids in Severe ANCA-Associated Vasculitis. N Engl J Med. 2020 Feb 13;382(7):622-631. doi: 10.1056/NEJMoa1803537.
-
Chen M, Jayne DRW, Zhao MH. Complement in ANCA-associated vasculitis: mechanisms and implications for management. Nat Rev Nephrol. 2017 Jun;13(6):359-367. doi: 10.1038/nrneph.2017.37.
-
Bekker P, Dairaghi D, Seitz L, et al. Characterization of Pharmacologic and Pharmacokinetic Properties of CCX168, a Potent and Selective Orally Administered Complement 5a Receptor Inhibitor, Based on Preclinical Evaluation and Randomized Phase 1 Clinical Study. PLoS One. 2016 Oct 21;11(10):e0164646. doi: 10.1371/journal.pone.0164646.
-
Xiao H, Dairaghi DJ, Powers JP, et al. C5a receptor (CD88) blockade protects against MPO-ANCA GN. J Am Soc Nephrol. 2014 Feb;25(2):225-31. doi: 10.1681/ASN.2013020143.
-
Jayne DRW, Bruchfeld AN, Harper L, et al. Randomized Trial of C5a Receptor Inhibitor Avacopan in ANCA-Associated Vasculitis. J Am Soc Nephrol. 2017 Sep;28(9):2756-2767. doi: 10.1681/ASN.2016111179.
-
Jayne DRW, Merkel PA, Schall TJ, et al. Avacopan for the Treatment of ANCA-Associated Vasculitis. N Engl J Med. 2021 Feb 18;384(7):599-609. doi: 10.1056/NEJMoa2023386.
-
Cortazar FB, Niles JL, Jayne DRW, et al. Renal Recovery for Patients with ANCA-Associated Vasculitis and Low eGFR in the ADVOCATE Trial of Avacopan. Kidney Int Rep. 2023 Feb 3;8(4):860-870. doi: 10.1016/j.ekir.2023.01.039.
-
Patel NJ, Jayne DRW, Merkel PA, et al. Glucocorticoid Toxicity Index scores by domain in patients with antineutrophil cytoplasmic antibody-associated vasculitis treated with avacopan versus standard prednisone taper: post-hoc analysis of data from the ADVOCATE trial. Lancet Rheumatol. 2023 Mar;5(3):e130-e138. doi: 10.1016/S2665-9913(23)00030-9.
-
Strand V, Jayne DRW, Horomanski A, Yue H, Bekker P, Merkel PA; ADVOCATE Study Group. The impact of treatment with avacopan on health-related quality of life in antineutrophil cytoplasmic antibody-associated vasculitis: a post-hoc analysis of data from the ADVOCATE trial. Lancet Rheumatol. 2023 Aug;5(8):e451-e460. doi: 10.1016/S2665-9913(23)00092-9.
-
Zonozi R, Aqeel F, Le D, Cortazar FB, et al. Real-World Experience With Avacopan in Antineutrophil Cytoplasmic Autoantibody-Associated Vasculitis. Kidney Int Rep. 2024 Mar 26;9(6):1783-1791. doi: 10.1016/j.ekir.2024.03.022.
-
European Medicines Agency. (n.d.). TAVNEOS (avacopan) oral capsules: EPAR product information. European Medicines Agency. https://www.ema.europa.eu/en/documents/product-information/tavneos-epar-...
-
Jayne DR, Gaskin G, Rasmussen N, et al. Randomized trial of plasma exchange or high-dosage methylprednisolone as adjunctive therapy for severe renal vasculitis. J Am Soc Nephrol. 2007 Jul;18(7):2180-8. doi: 10.1681/ASN.2007010090.
-
Odler B, Riedl R, Geetha D, et al. The effects of plasma exchange and glucocorticoids on early kidney function among patients with ANCA-associated vasculitis in the PEXIVAS trial. Kidney Int. 2025 Mar;107(3):558-567. doi: 10.1016/j.kint.2024.11.029.
-
Walsh M, Collister D, Zeng L, et al. The effects of plasma exchange in patients with ANCA-associated vasculitis: an updated systematic review and meta-analysis. BMJ. 2022 Feb 25;376:e064604. doi: 10.1136/bmj-2021-064604.
-
Bitoun S, Henry J, Desjardins D, et al. Rituximab Impairs B Cell Response But Not T Cell Response to COVID-19 Vaccine in Autoimmune Diseases. Arthritis Rheumatol. 2022 Jun;74(6):927-933. doi: 10.1002/art.42058.
-
Belgian Superior Health Council, Vaccination of immunocompromised or chronically ill children and/or adults, n°9158, September 2019.
-
Schweitzer L, Miko BA, Pereira MR. Infectious Disease Prophylaxis During and After Immunosuppressive Therapy. Kidney Int Rep. 2024 Apr 25;9(8):2337-2352. doi: 10.1016/j.ekir.2024.04.043.
-
Conseil Supérieur de la Santé.Vaccination antipneumococcique (adultes). Bruxelles: CSS; 2022. Avis n° 9674. Diagnostic et traitement de l’infection tuberculeuse latente. Guide pratique destiné aux professionnels de la santé, Fares, février 2020, Bruxelles, Belgique.
-
Kronbichler A, Kerschbaum J, Gopaluni S, et al. Trimethoprim-sulfamethoxazole prophylaxis prevents severe/life-threatening infections following rituximab in antineutrophil cytoplasm antibody-associated vasculitis. Ann Rheum Dis. 2018 Oct;77(10):1440-1447. doi: 10.1136/annrheumdis-2017-212861.>
-
Fragoulis GE, Dey M, Zhao S, et al. Systematic literature review informing the 2022 EULAR recommendations for screening and prophylaxis of chronic and opportunistic infections in adults with autoimmune inflammatory rheumatic diseases. RMD Open. 2022 Nov;8(2):e002726. doi: 10.1136/rmdopen-2022-002726.
-
Wijetilleka S, Jayne DR, Mukhtyar C, et al. Recommendations for the management of secondary hypogammaglobulinaemia due to B cell targeted therapies in autoimmune rheumatic diseases. Rheumatology (Oxford). 2019 May 1;58(5):889-896. doi: 10.1093/rheumatology/key394.
Conflits d’intérêt
J.M. déclare une activité de consultance et/ou un support financier pour des activités de recherche de la part d’Alexion Pharmaceuticals, AstraZeneca, Bayer, CSL Vifor, EG Specialty Care, GlaxoSmithKline, Novartis, Sanofi-Genzyme, Sobi et Versantis. Les autres auteurs n’ont pas de conflit d’intérêt. Contributions MB, HG et JM ont rédigé une première version du manuscrit et ont préparé les tables et les figures. SL, CC, MT, SA, RD, MV, IR, FK, MB, FA, HF et FS ont relu, corrigé, et adapté la version initiale du manuscrit. Tous les auteurs ont approuvé la version définitive.
Affiliations
1. Service de Néphrologie, CHU UCL Namur – site Sainte-Elisabeth, Namur ;
2. Service d’Anatomie Pathologique, Cliniques universitaires Saint-Luc, Bruxelles ;
3. Service de Biologie clinique, CHU UCL Namur – site Sainte-Elisabeth, Namur ;
4. Service de Pneumologie, CHU UCL Namur – site Sainte-Elisabeth, Namur ;
5. Service de Rhumatologie – CHU UCL Namur – site Sainte-Elisabeth, Namur ;
6. Service de Pathologies Infectieuses, CHU UCL Namur – site Sainte-Elisabeth, Namur ;
7. Département d’Imagerie Médicale – CHU UCL Namur – site Sainte-Elisabeth, Namur
* Les Docteures Bennani et Georgery ont contribué de manière équivalente à ce travail et sont co-premières auteures. Ce travail a été réalisé lors du passage du Dr Bennani comme médecin spécialiste en formation dans le Service de Néphrologie du CHU UCL Namur – site Sainte-Elisabeth.
Correspondance
Pr Johann Morelle
CHU UCL Namur – site Sainte-Elisabeth
Service de Néphrologie
Place Louise Godin 15
B-5000 Namur
johann.morelle@chuuclnamur.uclouvain.be