Vaccination contre le pneumocoque
Deux nouveaux vaccins conjugués (PCV) sont actuellement disponibles en prévention de l’infection à pneumocoque (conjugué 20 valent, PCV20 - Apexxnar® et conjugué 15 valent, PCV15 - Vaxneuvance®). Deux plus anciens vaccins (conjugué 13 valent, PCV13 - Prevenar 13®, et vaccin polysaccharidique non conjugué 23 valent, PPV23 - Pneumovax 23®) sont toujours disponibles, mais leur place est amenée à progressivement significativement se réduire. Le principe des vaccins conjugués est d’utiliser des composants polysaccharidiques de la capsule liés (conjugués) à des protéines, ce qui permet d’induire une réponse impliquant les lymphocytes T, qui est de manière générale à la fois plus robuste et plus durable, et induit un effet sur le portage bactérien grâce à la stimulation de l’immunité muqueuse (1). Grâce à ce dernier avantage, la vaccination offre un bénéfice à l’échelle de la population, bien qu’un phénomène de remplacement des souches couvertes par les vaccins par les souches non couvertes se produise dans une certaine mesure.
En 2021, les vaccins PCV13, PCV15, PCV20, PPV23 contenaient respectivement 34,4%, 40,3%, 66,6% et 72,1% des sérotypes provenant d’isolats issus de maladies invasives à pneumocoque chez les adultes de ≥16 ans en Belgique (2).
Les données les plus probantes quant au bénéfice de la vaccination par vaccin conjugué contre le pneumocoque proviennent de l’étude CAPITA, dans laquelle le vaccin PCV13 offrait chez les 65 ans et plus, par rapport à un placebo, une protection de 75% contre les maladies invasives à pneumocoque des sérotypes vaccinaux, et d’environ 45% contre les pneumonies communautaires à pneumocoque des sérotypes vaccinaux (3). Concernant les nouveaux vaccins PCV15 et PCV 20, on ne dispose actuellement pas d’étude d’efficacité clinique, mais bien de données d’immunogénicité obtenues au terme d’essais de phase III. En résumé, la vaccination par le PCV15 a démontré une réponse en anticorps fonctionnels non-inférieure à celle du PCV13 (pour les sérotypes communs aux deux vaccins). Lorsqu’elle était suivie du PPV23, la réponse était globalement comparable (ou supérieure, pour certains sérotypes communs) à celle du PCV13 suivi du PPV23. Pour le PCV20, comparé au schéma PCV13 suivi du PPV23 chez les plus de 60 ans, les taux d’anticorps fonctionnels étaient non-inférieurs à ceux pour les sérotypes communs avec PCV13, et non inférieurs pour ceux communs avec PPV23, sauf le sérotype 8 mais pour lequel la réponse semblait tout de même bonne. Il a également été démontré que la réponse au PCV13 était inférieure chez les patients pré-vaccinés 1 à 5 ans auparavant par PPV23 par rapport à ceux pré-vaccinés par PCV13 (4).
La place de la vaccination antipneumococcique chez l’enfant ne sera pas revue dans ce paragraphe.
Chez l’adulte, la vaccination est recommandée (2) :
I) chez les adultes à risque spécifiquement accru d’infection pneumococcique (trouble immunitaire congénital ou acquis, y compris VIH, asplénie, drépanocytose, hémoglobinopathie, fuite de liquide céphalo-rachidien, implant cochléaire)
II) chez les adultes avec co-morbidités chroniques cardiaques, pulmonaires, hépatiques, rénales, neurologiques, diabétiques, ou chez les fumeurs.
III) Chez les adultes de 65 ans et plus, même en bonne santé.
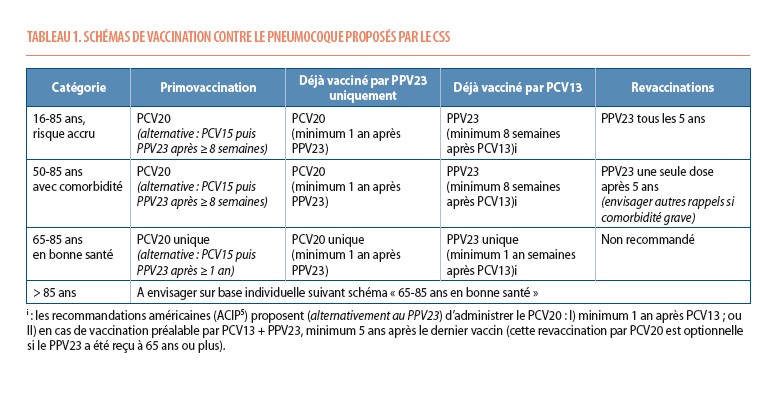
Les schémas de vaccination proposés en Belgique selon le patient et les antécédents de vaccination basés sur l’avis du CSS sont détaillés dans la table 1. Notons que les recommandations américaines accordent une place au vaccin PCV20 même en cas de vaccination préalable par PCV13 (5).
Les critères de remboursement de l’INAMI pour le PCV20 différent cependant, puisqu’il n’est accordé aux adultes qu’entre 65 et 80 ans n’ayant pas été préalablement vaccinés (sauf PPV23) et qui en plus présentent au moins une des comorbidités mentionnées au point II). Un avantage du vaccin PCV20 est sa simplicité d’administration (une dose) et son coût inférieur aux combinaisons de vaccins conjugués puis polysaccharidiques.
Vaccination contre le RSV
Initialement surtout reconnue chez l’enfant, la morbi-mortalité induite chez l’adulte par le virus respiratoire syncitial (RSV) est de mieux en mieux connue, en particulier chez les patients fragiles (immunodéficience, maladies pulmonaires, cardiaques, rénales chroniques, diabète, obésité, patients institutionalisés). Il a été rapporté qu’un quart à un tier des personnes âgées infectées par le RSV devaient être hospitalisées et 5% étaient hospitalisées aux soins intensifs (6). En Belgique, l’étude du réseau hospitalier sentinelle a démontré que avant 2021, 7,3% des patients de 65 ans et plus admis pour infection respiratoire aiguë sévère étaient infectées par le RSV, avec un taux de létalité de 11,3% (7). En Europe, 92% des adultes hospitalisés pour le RSV avaient plus de 65 ans (8). Il est important de noter que la pandémie COVID et les mesures sanitaires prises en réponse ont profondément modifié l’épidémiologie et la saisonnalité du RSV (survenue de plusieurs pics, retardés par rapport aux pics automnaux habituellement décrits), et il est difficile de prédire comment les choses évolueront.
De nombreuses années de recherche furent nécessaires à la découverte d’un vaccin efficace contre le RSV. Dans les années 1960, les premiers essais furent infructueux, avec notamment la survenue d’infections plus sévères (vaccine enhanced disease) lors d’essais d’un vaccin inactivé au formol (9). Finalement, c’est la compréhension de l’immunogénicité de la glycoprotéine de fusion F dans sa forme pré-fusion, plutôt que post-fusion, qui permit un bond en avant.
3 vaccins ont récemment montré des résultats favorables : le vaccin RSVPreF (Abrysvo®), le vaccin RSVPreF3 (Arexvy®) et le vaccin mRNA-1345 (produit par Moderna®). Les deux premiers sont des vaccins à sous-unité protéique recombinante, respectivement sans et avec adjuvant (même adjuvant que le Shingrix®), le troisième est un vaccin à ARNm, sur le même principe que les vaccins COVID à ARNm. Les deux premiers ont été approuvés par l’EMA durant l’été 2023 tandis que le troisième est actuellement en cours d’évaluation par celle-ci et l’homologation pourrait intervenir fin 2023 ou début 2024. A l’heure d’écrire ces lignes, seul le vaccin Arexvy® est disponible sur le marché belge. Il s’administre en une seule injection IM. Le vaccin Abrysvo® est attendu pour mi-décembre 2023.
Les vaccins Abrysvo® et Arexvy® ont montré des efficacités vaccinales de respectivement de 67 et 83% pour la prévention des infections des voies respiratoires inférieures associées au RSV, chez les adultes de 60 ans et plus (10,11). Il est important de noter que ces efficacités ne peuvent être directement comparées puisque les vaccins n’ont pas été évalués directement l’un par rapport à l’autre. L’efficacité semblait encore meilleure dans ces études pour les infections définies comme sévères - mais celles-ci n’étaient pas définies comme la survenue d’une forme menant à l’hospitalisation ou la mortalité, ce qui est l’une des limitations des études. Parmi les autres limitations des études, mentionnons le fait que la majorité des patients avaient moins de 70 ans et étaient assez peu comorbides, et le fait que le suivi était limité dans le temps. De manière intéressante, pour le vaccin Arexvy®, une seconde dose un an après la première n’apportait pas de bénéfice de protection. On note une efficacité vaccinale qui semble persister lors de la seconde saison de suivi ; des données à plus long terme ne sont pas encore disponibles. De plus, aucune donnée n’est actuellement disponible concernant l’usage des vaccins contre le RSV chez les immunodéprimés. Les études n’ont à ce jour pas montré de signal de sécurité inquiétant. Des études en conditions de vie réelle font défaut vu l’homologation récente des vaccins. Sur base des données disponibles, il a été estimé que l’administration de 1 million de doses de vaccin Arexvy® permettraient de prévenir, en deux saisons, 3190 hospitalisations et 155 décès aux USA chez les plus de 60 ans (12).
Actuellement, compte tenu de ces données limitées, tout particulièrement chez les patients fragiles, le CSS conclut que la vaccination peut être proposée sur une base individuelle aux patients à risque élevé âgés de plus de 60 ans et présentant au moins un facteur de risque d’une maladie grave due au RSV, une recommandation proche des recommandations américaines (7,12). En Grande-Bretagne, la vaccination est proposée à tous au-delà de 75 ans (13). A l’heure actuelle, aucun remboursement n’est prévu pour le vaccin.
Notons aussi que la vaccination contre le RSV suscite de l’intérêt chez la femme enceinte, pour protéger le nourrisson contre la bronchiolite. Le vaccin Abrysvo® a démontré une efficacité dans la prévention des infections sévères des voies respiratoires inférieures liées au RSV lorsqu’il était administré chez les femmes enceinte entre la 24e et la 36e semaine (14). Néanmoins, la place du vaccin dans le contexte de la grossesse reste actuellement discutée, notamment parce que d’autres stratégies de prévention tels les anticorps monoclonaux ont été développées et seront prochainement disponibles, et que la place relative de l’une ou l’autre méthode de prévention est difficile à définir. A l’heure d’écrire ces lignes, le vaccin Abrysvo® n’est pas indiqué chez la femme enceinte.
Vaccination contre la grippe
En plus de la mise à jour annuelle de la composition du vaccin antigrippal en fonction des sous-types attendus selon les prévisions de l’OMS, un vaccin fortement dosé (Efluelda®) est disponible depuis la saison 2022-2023. Tout comme les vaccins classiques à dose standard, il s’agit d’un vaccin inactivé qui couvre 4 sérotypes, mais il contient une dose majorée de 60 μg d’antigène par souche de virus grippal, au lieu de 15 μg. Il faut noter que les vaccins contre la grippe de type vaccin inactivé adjuvanté, vaccin recombinant, et vaccin vivant, disponibles notamment aux USA, ne sont pas sur le marché belge.
En raison de la diminution de la réponse vaccinale avec l’âge, alors que les personnes âgées paient le plus lourd tribut à la grippe, le vaccin fortement dosé a été spécifiquement étudié chez les personnes âgées, et semble particulièrement indiqué à partir de 65 ans. Une étude cluster-randomisée a ainsi montré un bénéfice modéré mais significatif de la dose élevée par rapport à la dose standard (OR de 0,873, IC à 95% de 0,776-0,982) sur le risque d’hospitalisation pour tableau grippal ou respiratoire aigu (15). D’autres études tendent à montrer un bénéfice du vaccin fortement dosé en terme de réduction des infections et des complications chez les plus de 65 ans (16,17).
Depuis le 1er décembre 2023, le remboursement du vaccin a été élargi par l’INAMI : il concerne désormais toutes les personnes de ≥ 75 ans, en plus des personnes de ≥ 65 ans qui séjournent dans un établissement de soins résidentiel (comme par exemple maison de repos et de soins, centre de convalescence, centre de jour...). Notons enfin que le CSS n’a pas encore défini la place précise et les indications exactes de ce vaccin en Belgique (18).
Vaccination contre le zona
Approuvé en mars 2018 par l’EMA, un vaccin recombinant non-vivant, avec adjuvant (Shingrix®) est disponible sur le marché belge depuis fin 2020. Il s’administre en deux doses séparées de deux mois. Un schéma accéléré (2 doses à 1 mois d’intervalle) est possible lorsque l’on souhaite offrir une protection plus rapide au patient (en particulier avant une immunodépression). Précédemment, un vaccin vivant atténué (Zostavax®) était disponible, mais son efficacité était significativement moindre, et il a été retiré du marché belge.
Il faut distinguer les vaccins destinés à la prévention du zona, qui font l’objet de ce paragraphe, des vaccins développés pour la prévention de la varicelle (Varilrix® et Varivax®), qui sont des vaccins vivants atténués et sont recommandés en Belgique uniquement à l’échelle individuelle, notamment chez les sujets (adultes, femmes avec désir de grossesse, avec projet d’immunosuppression) à risque de varicelle grave et non immunisés (19). Ces derniers ne seront pas détaillés dans ce chapitre.
Le vaccin Shingrix® a été largement étudié dans les populations d’adultes immunocompétents de plus de 50 ans. Deux larges études randomisées et contrôlées regroupant près de 30.000 participants ont mis en évidence une efficacité vaccinale pour la prévention du zona de 97٪ à un peu plus de 3 ans chez les plus de 50 ans et de 91٪ chez les plus de 70 ans (20,21). Une étude de suivi à plus de 7 ans a montré un maintien d’un niveau élevé de protection, qui semblait se stabiliser et ne plus décroitre au cours de la 6e et 7e année autour de 85%. Au total il a été calculé sur base de ces données qu’il faut vacciner 23,4 personnes pour prévenir un zona sur la période de suivi de 7 ans (22). La protection contre la névralgie post-herpétique, complication la plus fréquente du zona, a également été démontrée, mesurée aux alentours de 90% à 3 ans.
Le vaccin Shingrix® a aussi été largement étudié (immunogénicité, réactogénicité, sécurité) sur de larges cohortes de patients immunodéprimés (plusieurs études randomisées contrôlées dans les contextes d’autogreffes de cellules souches hématopoiétiques (CSH), d’hémopathies malignes, de greffe rénale et de cancer solide). Toutes ces études ont démontré que le vaccin prodiguait une forte réponse immunitaire (23-26). L’une des études s’intéressait également à la réponse clinique, dans le contexte des autogreffes, et démontrait une efficacité vaccinale de près de 70% (23).
Enfin, il faut savoir que tant chez les immunocompétents que les immunodéprimés, les données de cohortes menées en conditions de vie réelle ont globalement confirmé le niveau d’efficacité démontre dans les RCT.
Le CSS recommande la vaccination par le Shingrix® pour les adultes immunocompétents de 60 ans et plus, et pour les immunodéprimés de cause médicamenteuse (y compris patients sous inhibiteurs de JAK) ou autre, âgés de 16 ans ou plus (27).
Récemment, le remboursement du Shingrix® par l’INAMI a été accordé pour les personnes âgées de 18 ans ou plus et présentant au moins une des conditions suivantes : cancer solide ou hémopathie maligne traitée endéans les 5 ans ; infection par le VIH; antécédent de greffe d’organe ou de CSH, ou patient candidat pour une greffe.
Vaccination contre la dengue
La dengue est une arbovirose pouvant parfois s’avérer sévère, dont l’incidence augmente actuellement en raison du changement climatique (28). La zone d’endémicité (Asie du Sud-Est, du Sud, Amérique latine, et également Afrique) est également en extension pour la même raison, et des cas de transmission sporadiques dans le Sud de l’Europe sont maintenant rapportés. Néanmoins, actuellement, les hospitalisations restent rares chez les voyageurs (29). Le risque de dengue sévère (fièvre hémorragique ou syndrome du choc lié à la dengue) augmente de manière nette en cas de réinfection par un autre sérotype, d’un facteur estimé entre 2 et 7, pour atteindre 2 à 4% (30). La raison en est un phénomène de antibody-dependent enhancement (ADE) of disease : une infection offre une protection à long-terme contre une réinfection par le même sérotype ; par contre, une infection par un autre sérotype induit la présence d’anticorps non-neutralisants. Ceux-ci ne neutralisent pas le virus, mais s’y fixent et forment un complexe virus-anticorps qui favorise l’entrée du virus en intracellulaire et augmente le risque de tempête cytokinique.
Un vaccin efficace (Qdenga®) a été développé contre la dengue et est approuvé par l’EMA depuis décembre 2022 et disponible en Belgique depuis mars 2023. Le vaccin Qdenga® est un vaccin vivant atténué, qui est donc contre-indiqué en cas d’immunodéficience. Il est basé sur le sérotype 2 de la dengue (DENV-2) sur lequel ont été ajoutés des gènes pour des protéines des DENV-1, DENV-3 et DENV-4. Il s’administre en deux injections séparées de 3 mois.
Le vaccin a été étudié enfants de plus de 4 ans et les adolescents et a démontré un important effet protecteur tant sur les dengues confirmées que les hospitalisations pour dengue (31,32). Néanmoins, il faut noter que l’efficacité vaccinale contre les infections était variable selon le statut sérologique pour la dengue (donc selon que l’on avait déjà été infecté préalablement), et selon le sous-type : efficacité meilleure pour les séropositifs, et pour le DENV-2 ; l’efficacité n’était pas démontrée pour DENV-4 et chez les séronégatifs pour DENV-3 (bien qu’elle ne puisse pour autant être exclue, en raison du nombre faible évalué). L’étude n’a pas montré de risque d’ADE lié à la vaccination, mais le recul étant limité, la prudence reste de mise, surtout chez les séronégatifs ; dans le cas d’un précédent vaccin contre la dengue (Dengvaxia®) – qui ne fut jamais commercialisé en Belgique – on avait démontré quelques années après sa mise sur le marché un risque majoré de dengue sévère. Chez les adultes (18-60 ans), l’efficacité de Qdenga® a été déduite d’une étude d’immunogénicité.
Pour ces différentes raisons, le CSS a émis un avis prudent et réservé quant aux indications vaccinales, qui rejoint celui émis par d’autres pays : le vaccin Qdenga® est recommandé pour les résidents, les voyageurs qui prévoient un séjour de plus de 4 semaines, ou les voyageurs fréquents, âgés de plus de 4 ans, à condition d’avoir eu une dengue auparavant et de recevoir le schéma complet de 2 doses avant le départ. Selon les données à venir, l’avis pourrait être mis à jour (33).
Vaccination antimalarique
De nombreux efforts sont mis en œuvre pour développer un vaccin antimalarique, avec plusieurs cibles potentielles à différents stades de la réplication du parasite (34).
Le seul vaccin actuellement distribué est le vaccin RTS,S (produit par GSK®) qui cibles les sporozoïtes et, administré à des enfants en bas âge, offre une protection modérée, de l’ordre de 50% la première année, qui diminue par la suite (35). Bien que pouvant sembler modeste, cette efficacité permet de sauver de nombreuses vies lorsque la vaccination est appliquée à large échelle dans des pays à haute endémicité. Compte tenu de la protection limitée, ce vaccin n’est pas envisagé comme mesure de protection du voyageur, pour lequel l'on cherche une haute protection individuelle plutôt qu’un bénéfice à l’échelle de la santé publique.
Correspondance
Dr Julien De Greef
Cliniques universitaires Saint-Luc
Service Maladies Infectieuses
Avenue Hippocrate 10
B-1200 Bruxelles
Références
- Rappuoli R, De Gregorio E, Costantino P. On the mechanisms of conjugate vaccines. Proceedings of the National Academy of Sciences. 2019;116(1):14-16.
- Conseil Supérieur de la Santé.Vaccination antipneumococcique (adultes). Bruxelles: CSS; 2022. Avis n° 9674.
- Bonten MJ, Huijts SM, Bolkenbaas M, et al. Polysaccharide conjugate vaccine against pneumococcal pneumonia in adults. N Engl J Med. 2015;372(12):1114-1125.
- Cannon K, Elder C, Young M, et al. A trial to evaluate the safety and immunogenicity of a 20-valent pneumococcal conjugate vaccine in populations of adults ≥65 years of age with different prior pneumococcal vaccination. Vaccine. 2021;39(51):7494-7502.
- Kobayashi M, Pilishvili T, Farrar JL, et al. Pneumococcal Vaccine for Adults Aged ≥19 Years: Recommendations of the Advisory Committee on Immunization Practices, United States, 2023. MMWR Recomm Rep. 2023;72(3):1-39.
- Nguyen-Van-Tam JS, O’Leary M, Martin ET, et al. Burden of respiratory syncytial virus infection in older and high-risk adults: a systematic review and meta-analysis of the evidence from developed countries. Eur Respir Rev. 2022;31(166).
- Conseil Supérieur de la Santé. Vaccination contre le VRS (adultes). Bruxelles: CSS; 2023. Avis n° 9725.
- Osei-Yeboah R, Spreeuwenberg P, Del Riccio M, et al. Estimation of the number of RSV-associated hospitalisations in adults in the European Union. J Infect Dis. 2023.
- Openshaw PJM, Chiu C, Culley FJ, Johansson C. Protective and Harmful Immunity to RSV Infection. Annu Rev Immunol. 2017;35:501-532.
- Walsh EE, Pérez Marc G, Zareba AM, et al. Efficacy and Safety of a Bivalent RSV Prefusion F Vaccine in Older Adults. N Engl J Med. 2023;388(16):1465-1477.
- Papi A, Ison MG, Langley JM, et al. Respiratory Syncytial Virus Prefusion F Protein Vaccine in Older Adults. N Engl J Med. 2023;388(7):595-608.
- Melgar M & Britton A. Evidence to Recommendations Framework Respiratory Syncytial Virus (RSV) in Adults [Presentation slides]. ACIP meeting, Atlanta, GA.
- Respiratory syncytial virus (RSV) immunisation programme: JCVI advice. In.
- Kampmann B, Madhi SA, Munjal I, et al. Bivalent Prefusion F Vaccine in Pregnancy to Prevent RSV Illness in Infants. N Engl J Med. 2023;388(16):1451-1464.
- Gravenstein S, Davidson HE, Taljaard M, et al. Comparative effectiveness of high-dose versus standard-dose influenza vaccination on numbers of US nursing home residents admitted to hospital: a cluster-randomised trial. Lancet Respir Med. 2017;5(9):738-746.
- Johansen ND, Modin D, Nealon J, et al. A Pragmatic Randomized Feasibility Trial of Influenza Vaccines. NEJM Evidence. 2023;2(2):EVIDoa2200206.
- Lee JKH, et al. Vaccine: X. 2023;14:100327. doi: 10.1016/j.jvacx.2023.100327.
- Conseil Supérieur de la Santé. Vaccination contre la grippe saisonnière - Saison hivernale 2023 - 2024. Bruxelles: CSS; 2023. Avis n° 9767.
- Conseil Supérieur de la Santé. Vaccination des enfants, des adolescents et des personnes à risque contre la varicelle. Bruxelles: CSS; 2017. Avis n° 9212.
- Cunningham AL, Lal H, Kovac M, et al. Efficacy of the Herpes Zoster Subunit Vaccine in Adults 70 Years of Age or Older. N Engl J Med. 2016;375(11):1019-1032.
- Lal H, Cunningham AL, Godeaux O, et al. Efficacy of an adjuvanted herpes zoster subunit vaccine in older adults. N Engl J Med. 2015;372(22):2087-2096.
- Boutry C, Hastie A, Diez-Domingo J, et al. The Adjuvanted Recombinant Zoster Vaccine Confers Long-Term Protection Against Herpes Zoster: Interim Results of an Extension Study of the Pivotal Phase 3 Clinical Trials ZOE-50 and ZOE-70. Clin Infect Dis. 2022;74(8):1459-1467.
- Bastidas A, de la Serna J, El Idrissi M, et al. Effect of Recombinant Zoster Vaccine on Incidence of Herpes Zoster After Autologous Stem Cell Transplantation: A Randomized Clinical Trial. Jama. 2019;322(2):123-133.
- Curran D, Matthews S, Rowley SD, et al. Recombinant Zoster Vaccine Significantly Reduces the Impact on Quality of Life Caused by Herpes Zoster in Adult Autologous Hematopoietic Stem Cell Transplant Recipients: A Randomized Placebo-Controlled Trial (ZOE-HSCT). Biol Blood Marrow Transplant. 2019;25(12):2474-2481.
- Stadtmauer EA, Sullivan KM, El Idrissi M, et al. Adjuvanted recombinant zoster vaccine in adult autologous stem cell transplant recipients: polyfunctional immune responses and lessons for clinical practice. Hum Vaccin Immunother. 2021;17(11):4144-4154.
- Dagnew AF, Ilhan O, Lee WS, et al. Immunogenicity and safety of the adjuvanted recombinant zoster vaccine in adults with haematological malignancies: a phase 3, randomised, clinical trial and post-hoc efficacy analysis. Lancet Infect Dis. 2019;19(9):988-1000.
- Conseil Supérieur de la Santé. Vaccination contre l’herpès zoster. Bruxelles: CSS; 2022. Avis n° 9684.
- Lenharo M. Dengue is breaking records in the Americas - what’s behind the surge? Nature. 2023.
- Wong JM, Rivera A, Volkman HR, et al. Travel-Associated Dengue Cases - United States, 2010-2021. MMWR Morb Mortal Wkly Rep. 2023;72(30):821-826.
- Halstead S, Wilder-Smith A. Severe dengue in travellers: pathogenesis, risk and clinical management. J Travel Med. 2019;26(7).
- Biswal S, Borja-Tabora C, Martinez Vargas L, et al. Efficacy of a tetravalent dengue vaccine in healthy children aged 4–16 years: a randomised, placebo-controlled, phase 3 trial. Lancet. 2020;395(10234):1423-1433.
- Biswal S, Reynales H, Saez-Llorens X, et al. Efficacy of a Tetravalent Dengue Vaccine in Healthy Children and Adolescents. N Engl J Med. 2019;381(21):2009-2019.
- Conseil Supérieur de la Santé. Vaccination contre la Dengue. Bruxelles: CSS; 2023. Avis n° 9739.
- Willyard C. The next frontier for malaria vaccination. Nature. 2023;618(7967):S20-s22.
- Efficacy and safety of RTS,S/AS01 malaria vaccine with or without a booster dose in infants and children in Africa: final results of a phase 3, individually randomised, controlled trial. Lancet. 2015;386(9988):31-45.