Introduction
Le traitement de l’hyperglycémie du diabétique de type 2 (non insulinodépendant) est aujourd’hui très codifié. Il repose principalement sur les recommandations de bonne pratique proposées annuellement par les Sociétés savantes de diabétologie aux États-Unis (American Diabetes Association ; ADA) et en Europe (European Association for the Study of Diabetes ; EASD). Les recommandations 2020 publiées dans la revue Diabetes Care actualisent et modifient celles de 2018-2019, sachant aujourd’hui le bon niveau de preuves de cardio- et néphroprotection rapportées pour les agonistes des récepteurs GLP-1 (GLP-1 RA pour Glucagon-like-Peptide-1 Receptor Agonists) et les inhibiteurs des transporteurs de glucose (gliflozines ou SGLT-2i pour Sodium Glucose Co-transporter-2 inhibitors) (1-3).
Le but de cet article est de proposer une synthèse de ces prises de position et ainsi de définir une stratégie thérapeutique moderne du diabète de type 2.
Avant les médicaments…
Précédant l’approche pharmacologique, l’ADA et l’EASD sacralisent le principe d’une personnalisation des objectifs d’hémoglobine glycatée (HbA1c) en fonction de l’état clinique du patient (1). En d’autres termes, la cible glycémique ne doit pas être identique chez un « jeune patient » diabétique de type 2 et chez un malade plus âgé, atteint de complications dégénératives, en particulier cardiovasculaires, amplifiant les risques d’hypoglycémie. Habituellement, l’objectif reste néanmoins une HbA1c de ≤ 7%. Par-delà, les recommandations font état de l’importance d’une décision médicale partagée favorisant, entre autres, la compliance (l’adhérence) au traitement. La place essentielle des règles alimentaires (a priori un régime hypocalorique) et de l’activité physique régulière est aussi soulignée par les experts. Ces mesures constitueront d’ailleurs le « fil rouge » tout au long du parcours thérapeutique du diabétique de type 2 (1,2).
Le temps de la monothérapie
Le traitement pharmacologique de première ligne reste, en 2020, la metformine. Il concerne tous les patients diabétiques de type 2, sauf s’il y a contre-indication à sa prescription. Cette position privilégiée du biguanide est d’abord liée à son efficacité (réduction d’HbA1c de l’ordre de 1.5%). La metformine réduit principalement la production hépatique du glucose responsable, entre autres, du phénomène de l’aube et des dérives glycémiques qu’il amène. Plusieurs bénéfices extraglycémiques ont été rapportés, en particulier cardiovasculaires dans l’essai UKPDS (United Kingdom Prospective Diabetes Study), ou oncologiques, avec potentiellement un effet « anti-cancer » suggéré par certains travaux (4,5). Enfin, le faible coût de la metformine est aussi, sur le plan sociétal, un argument retenu par les experts. Ses effets secondaires et limitations doivent évidemment être intégrés dans la décision thérapeutique personnalisée (4).
Le temps de la bithérapie
Le diabète de type 2 est une maladie évolutive marquée par un déclin progressif de la fonction des cellules B, une insulinopénie et, en parallèle, une augmentation des glycémies. C’est à ce stade, dans une approche conventionnelle, qu’est habituellement renforcée par l’ajout d’un second médicament hypoglycémiant une monothérapie par metformine (6).
Les recommandations ADA-EASD 2020 nuancent et modifient cette stratégie, en particulier chez les sujets aux antécédents cardiovasculaires (prévention secondaire) et/ou rénaux, qu’il convient donc d’identifier en priorité. Ce sont eux, en effet, dans l’exorde des experts, qui seront les premiers bénéficiaires des nouvelles classes de médicaments hypoglycémiants cardio- et néphroprotecteurs.
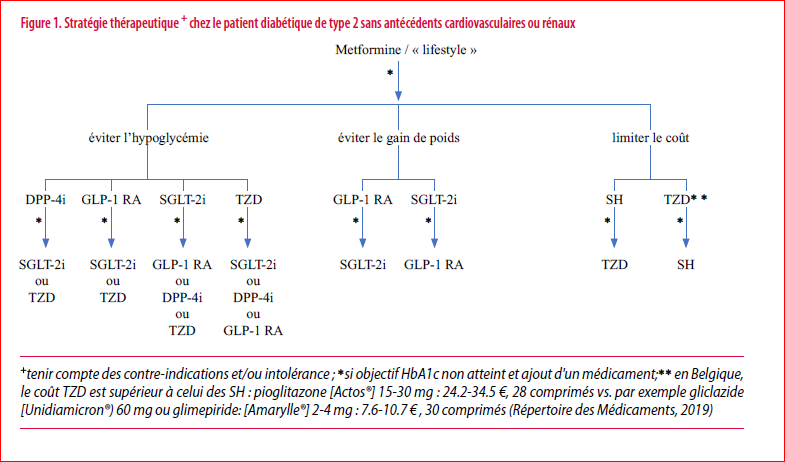
En l’absence d’antécédents cardiovasculaires et/ou rénaux, le choix de l’agent hypoglycémiant à rajouter à la metformine se fera en fonction du contexte clinique, des caractéristiques du médicament, y compris ses effets secondaires (hypoglycémies ; gain pondéral) et contre-indications (par exemple insuffisance rénale) et du « colloque singulier » avec le malade. La palette, dans cette situation, est très étendue : sulfamides hypoglycémiants (SH), glitazones (TZD), dipeptidyl-peptidase-4 (DPP-4) inhibiteurs, SGLT-2i, GLP-1 RA et insuline basale, en sachant que la réduction d’HbA1c, avec chacune de ces classes thérapeutiques, varie en général de 0.7 à 1.0% (sauf pour l’insuline où elle peut être plus importante).
En pratique, le choix thérapeutique doit être guidé en fonction d’un objectif « de terrain », soit (a) une réduction du risque d’hypoglycémie (sont alors privilégiés DPP-4i, glitazones, SGLT-2i et GLP-1 RA), soit (b) une perte de poids (SGLT-2i et GLP-1 RA) soit (c) une dimension économique et le coût (ou la disponibilité) du médicament (sont alors mentionnés les sulfamides hypoglycémiants et les glitazones) (Figure 1). La même stratégie se décline en cas de recours à une trithérapie. Dans l’arbre décisionnel ADA-EASD, les sulfamides hypoglycémiants (uniquement de seconde génération) et l’insuline basale se retrouvent en aval de la cascade thérapeutique, dès lors que sont considérés les objectifs de réduction du risque d’hypoglycémie et/ou de gain de poids.
En présence d’antécédents cardiovasculaires avérés (de type athéromatose ou insuffisance cardiaque) ou d‘un passé rénal, la démarche thérapeutique proposée par l’ADA-EASD se singularise par rapport à l’approche traditionnelle. La prescription d’un GLP-1 RA et/ou d’un SGLT-2i doit en effet être privilégiée, en ajout à la metformine, indépendamment du taux d’HbA1c. Le choix du traitement « antidiabétique» ne repose donc plus sur l’HbA1c mais sur l’état cardiovasculaire et/ou rénal du patient. En pratique, lorsque le tableau clinique prédominant est celui d’une maladie athéromateuse (prévention cardiovasculaire secondaire classique, mais aussi présence d’un indicateur de haut risque cardiovasculaire, c’est-à-dire > 55 ans avec, à l’imagerie, une lésion athéromateuse sténosante > 50% sur un tronc coronaire, carotidien ou sur une artère des membres inférieurs ou s’il y a hypertrophie ventriculaire gauche), l’ADA-EASD recommande d’associer à la metformine un GLP-1 RA ou un SGLT-2i (si la filtration glomérulaire (eGFR) l’autorise) dont le bénéfice cardiovasculaire a été établi (Figure 2).
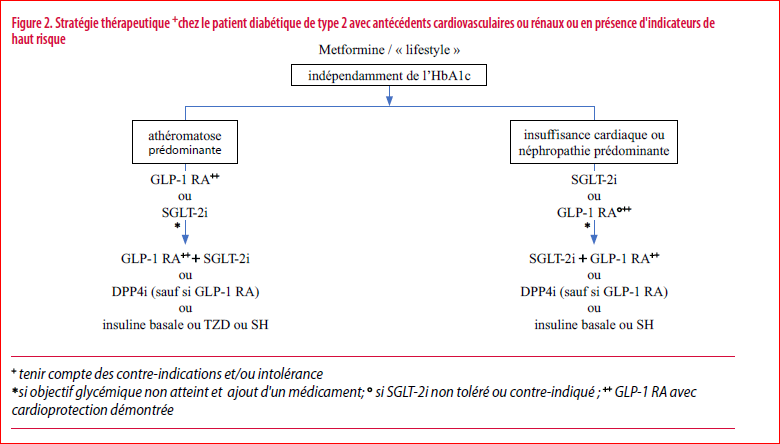
Cette cardioprotection a été principalement démontrée pour les GLP-1 RA par le liraglutide (Victoza®), le semaglutide (Ozempic®) et le dulaglutide (Trulicity®) (7-9) et pour les SGLT-2i, par l’empagliflozine (Jardiance®) et la canagliflozine (Invokana®).S’agissant de la dapagliflozine (Forxiga®), dans l’étude DECLARE-TIMI 58 qui incluait une majorité de patients en prévention primaire (59.4%), le bénéfice l’était sur un objectif primaire composite d’hospitalisation pour décompensation cardiaque ou décès cardiovasculaire. (10-13).
Lorsque le tableau clinique prédominant est celui d’une insuffisance cardiaque (en particulier si la fraction d’éjection < 45%) ou d’une néphropathie (eGFR 30-60 ml/min/1.73 m2 ou albuminurie), le premier choix sera un SGLT-2i (empagliflozine, canagliflozine, dapagliflozine) ou, en cas de contre-indication ou effets secondaires, un GLP-1 RA à bénéfice cardiovasculaire (14-22) (Figure 2). Il est intéressant de mentionner que le bénéfice de la dapagliflozine dans l’insuffisance cardiaque a été retrouvé chez des sujets non diabétiques dans l’étude DAPA-HF (21). Une stratégie identique est proposée en cas de trithérapie avec, en aval, en cas de contre-indications ou intolérance, un DPP-4i (sauf si un GLP-1 RA est déjà prescrit), une insuline basale ou un sulfamide hypoglycémiant. La saxagliptine n’est pas recommandée en cas d’insuffisance cardiaque qui exclut la prescription d’une glitazone.
L’ensemble de ces propositions, en prévention primaire ou secondaire, est basé sur les résultats récents des grandes études interventionnelles (CVOT pour Cardiovascular Outcome Trials) (7-21). Elles ont fait l’objet d’une revue récente dans Louvain Med (23).
Le temps de l’insulinorequérance
Ce que les recommandations mentionnent, c’est que, chez la majorité des diabétiques de type 2, les GLP-1 RA doivent être administrés préalablement à toute insulinothérapie, sachant leurs avantages, en particulier l’absence d’hypoglycémies et la perte (vs. le gain) de poids. Font exception des malades diabétiques de type 2 symptomatiques, avec un HbA1c > 10% et/ou une glycémie >300 mg/dl ou des patients chez qui un diagnostic de diabète de type 1 est plausible. Cela étant, si l’objectif glycémique n’est pas atteint par un GLP-1 RA, une insulinothérapie « réfléchie » s’impose. Il s’agit, dans un premier temps, d’une injection « bedtime » d’une insuline basale NPH ou analogue lent (première ou deuxième génération), qui peut d’ailleurs être combiné à un GLP-1 RA (iDeglira [Xultophy®] ou iGlarLix [Suliqua®], ou à une injection hebdomadaire d’un GLP-1 RA à effet retard comme le dulaglutide, le semaglutide ou l’exenatide (Bydureon®).
L’évolution clinique habituelle nécessitera cependant le plus souvent une intensification avec d’abord l’ajout à l’insuline basale d’une insuline (ultra) rapide au repas principal (schéma basal +), puis d’une insuline prandiale à chaque repas (schéma basal-bolus). Une alternative est l’injection avant le petit-déjeuner et le repas du soir d’une insuline prémélangée (30/70 ; 25/75 ; 50/50). Quoi qu’il en soit, l’option du schéma à privilégier doit être personnalisée et la titration de la (des) dose(s) guidée par l’autocontrôle glycémique.
Conclusion
Edictées par des Sociétés emblématiques de diabétologie, ces recommandations se veulent des balises de bonne pratique dans la prise en charge quotidienne du patient diabétique de type 2. L’objectif à terme est une réduction des complications micro- et macroangiopathiques.
D’autres guidelines ont été publiées au cours des derniers mois. Celles de la Société Francophone du Diabète (SFD) sont globalement en phase avec l’ADA-EASD (24). Celles de la Société Européenne de Cardiologie (ESC), rédigées majoritairement par des cardiologues, ont une approche quelque peu différente : elles gomment l’utilisation de metformine en première ligne chez les diabétiques de type 2 nouvellement diagnostiqués qui ont déjà un antécédent cardiovasculaire et proposent d’initier d’emblée chez eux, en monothérapie, un traitement par GLP-1 RA ou SGLT-2i (25). La pertinence théorique des recommandations ADA-EASD fait néanmoins aujourd’hui le quasi consensus parmi les diabétologues. Leur application pratique sur le terrain reste cependant conditionnée à des règlements internes propres à chaque pays. En Belgique, DPP-4i, SGLT-2i et GLP-1 RA sont autorisés et remboursés par les organismes assureurs dès la bithérapie, en association avec la metformine. Néanmoins le taux d’HbA1c à la première prescription de DPP-4i ou SGLT-2i doit se situer entre 7.0 et 9.0%. Quant aux GLP-1 RA, ils sont réservés aux patients dont l’index de poids corporel est supérieur à 30 kg/m2, à condition que l’HbA1c soit supérieure à 7.5%. Il est légitime d’anticiper que ces critères seront encore modifiés en fonction des données de la littérature.
Bref, par-delà certaines limitations administratives, les recommandations 2020 de l’ADA-EASD permettent aux cliniciens, dans le cadre d’une approche personnalisée, une démarche thérapeutique rationnelle, avec l’objectif d’une maîtrise glycémique et d’un meilleur contrôle des complications macrovasculaires et de la néphropathie. Elles sont donc une avancée essentielle au service des patients. Il est néanmoins probable que ces règles thérapeutiques soient encore adaptées dans les prochains mois sur base des résultats d'études très récentes ou d’essais en cours, tant dans le champ cardiovasculaire, y compris en prévention primaire, que rénal.
Correspondance
Pr. (ém.) Martin Buysschaert
Cliniques universitaires Saint-Luc
Service d'Endocrinologie et Nutrition (Pr D. Maiter)
Avenue Hippocrate 10
B-1200 Bruxelles
Références
- American Diabetes Association. Pharmacologic Approaches to Glycemic Treatment: Standards of Medical Care in Diabetes-2020. Diabetes Care. 2020 Jan;43(Suppl 1): S98-S110.
ouvrir danc Pubmed - Buse JB, Wexler DJ, Tsapas A, Rossing P, Mingrone G, Mathieu C, et al. 2019 Update to: Management of Hyperglycemia in Type 2 Diabetes, 2018. A Consensus Report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2020 Feb;43(2):487-493.
ouvrir dans Pubmed - Davies MJ, D’Alessio DA, Fradkin J, et al. Management of Hyperglycemia in Type 2 Diabetes, 2018. A Consensus Report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2018;41:2669-701.
- Buysschaert M, Djrolo F, Amoussou Guenou et al. La metformine revisitée et consolidée en 2016 : un point de vue consensuel de l’Afrique à l’Europe. Med Mal Metab 2016; 10:151-154.
- UK Prospective Diabetes Study (UKPDS) Group. Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34). Lancet. 1998 Sep 12;352(9131):854-65.
ouvrir dans Pubmed - Buysschaert M. Diabétologie Clinique, 4e Edition, De Boeck, Louvain-la-Neuve, Paris, 2011.
- Marso SP, Daniels GH, Brown-Frandsen K, et al. LEADER Steering Committee; LEADER Trial Investigators. Liraglutide and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med. 2016 Jul 28;375(4):311-22.
ouvrir Pubmed - Marso SP, Bain SC, Consoli A, et al.; SUSTAIN-6 Investigators. Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes. N Engl J Med. 2016 Nov 10;375(19):1834-1844.
ouvrir Pubmed - Gerstein HC, Colhoun HM, Dagenais GR, et al. Dulaglutide and cardiovascular outcomes in type 2 diabetes (REWIND): a double-blind, randomized placebo-controlled trial. Lancet. 2019; 394(10193):121-130.
ouvrir Pubmed - Zinman B, Wanner C, Lachin JM, et al.; EMPA-REG OUTCOME Investigators. Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. N Engl J Med. 2015 Nov 26;373(22):2117-28.
ouvrir Pubmed - Neal B, Perkovic V, Mahaffey KW, et al.; CANVAS Program Collaborative Group. Canagliflozin and Cardiovascular and Renal Events in Type 2 Diabetes. N Engl J Med. 2017 Aug 17;377(7):644-657.
ouvrir dans Pubmed - Wiviott SD, Raz I, Bonaca MP, et al.; for DECLARE–TIMI 58 Investigators. Dapagliflozin and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med. 2019 Jan 24;380(4):347-357.
ouvrir dans Pubmed - Buysschaert M. Dapagliflozin and cardiovascular events in type 2 diabetes: the model of the DECLARE-TIMI 58 TRIAL. Louvain Med. 2019; 138 (1): 3-7.
- Mann JFE, Ørsted DD, Brown-Frandsen K, et al.; LEADER Steering Committee and Investigators. Liraglutide and Renal Outcomes in Type 2 Diabetes. N Engl J Med. 2017 Aug 31;377(9):839-848.
ouvrir dans Pubmed - Gerstein HC, Colhoun HM, Dagenais GR, et al. Dulaglutide and renal outcomes in type 2 diabetes: an exploratory analysis of the REWIND randomised, placebo-controlled trial. Lancet. 2019 ; Jul 13;394(10193):131-138.
ouvrir dans Pubmed - Wanner C, Inzucchi SE, Lachin JM, et al.; for EMPA-REG OUTCOME Investigators. Empagliflozin and Progression of Kidney Disease in Type 2 Diabetes. N Engl J Med. 2016;375: 323-334.
ouvrir dans Pubmed - Mosenzon O, Wiviott SD, Cahn A, et al. Effects of dapagliflozin on development and progression of kidney disease in patients with type 2 diabetes: an analysis from the DECLARE-TIMI 58 randomised trial. Lancet Diabetes Endocrinol. 2019 Aug;7(8):606-617.
ouvrir dans Pubmed - Perkovic V, Jardine MJ, Neal B, et al.; CREDENCE Trial Investigators. Canagliflozin and Renal Outcomes in Type 2 Diabetes and Nephropathy. N Engl J Med. 2019 Jun 13;380(24):2295-2306.
ouvrir dans Pubmed
ouvrir dans Pubmed - Buysschaert M. La canagliflozine (Invokana®) est associée à une néphro – cardioprotection exemplaire dans le diabète de type 2. Synopsis de l’étude CREDENCE. Louvain Med. 2019; 139 (5): 255-260.
- Buysschaert M. Les SGLT-2 inhibiteurs sont-ils une approche thérapeutique holistique du diabète de type 2 ? Le point après l’essai EMPA-REG OUTCOME. Louvain Med. 2017; 136: 293-299.
- McMurray JJV, Solomon SD, Inzucchi SE, et al. Dapagliflozin in patients with heart failure and reduced ejection fraction. N Engl J Med. 2019 Nov 21;381(21):1995-2008.
ouvrir dans Pubmed - Buysschaert M, Preumont V, Buysschaert B. Médicaments hypoglycémiants dans le diabète de type 2 et néphroprotection : un nouvel axe thérapeutique ? Med Mal Metab 2020 ;14 :77-84.
- Buysschaert M, Buysschaert B, Paris I, Medina J.L., Bergman M, Preumont V. Nouveaux traitements du diabète de type 2 : de leur sécurité/bénéfice cardiovasculaire à la néphroprotection. Louvain Med 2020; 139 (01): 2-10.
- Darmon P, Bauduceau B, Bordier L, Bringer J, Chabrier G, Charbonnel B, et al ; pour la Société Francophonedu Diabète (SFD). Prise de position de la Société Francophone du Diabète (SFD) sur la prise en charge médicamenteuse de l’hyperglycémie du patient diabétique de type 2. Med Mal Metab 2019; 13:711-732.
- Cosentino F, Grant PJ, Aboyans V, Bailey CJ, Ceriello A, Delgado V, et al. 2019 ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD: The Task Force for diabetes, pre-diabetes, and cardiovascular diseases of the European Society of Cardiology (ESC) and the European Association for the Study of Diabetes (EASD). Eur Heart J. 2020 Jan 7;41(2):255-323.
ouvrir dans Pubmed