Les cancers gynécologiques
Jean-François Baurain, Mathieu Luyckx, Jean-Luc Squifflet
Les cancers gynécologiques sont des maladies souvent diagnostiquées à un stade avancé. Dans le cancer du col de l’utérus par exemple, même s’il existe un dépistage et une vaccination préventive pour le cancer du col de l’utérus, près d’un tiers des patientes présentant un cancer du col de l’utérus vont en décéder. L’immunothérapie permet d’augmenter la survie de ces patientes avec une maladie avancée. Depuis 2024, les anticorps anti PD-1 sont également administrés pendant la radiothérapie des patientes avec un cancer du col localement avancé, sans métastases à distance, pour améliorer encore le contrôle local et la guérison de ces patientes.
Le cancer de l’endomètre est symptomatique dans 90% des cas (métrorragies) et est donc plus souvent diagnostiqué à un stade précoce, mais 10 à 20% de ces cancers sont diagnostiqués à un stade avancé ou vont récidiver. Le cancer endométrial est une maladie plus hétérogène. Les patientes ayant un cancer dit MSI (MicroSatellite Instable), suite à un défaut de réparation de l’ADN, répondent excessivement favorablement à l’immunothérapie avec des réponses parfois complètes et de très longue durée. Par contre, pour les patientes ayant un cancer dit MSS (MicroSatellite Stable), des options supplémentaires sont toujours nécessaires.
Le cancer de l’ovaire est souvent asymptomatique, et lorsqu’il est diagnostiqué, il est fréquemment déjà étendu à toute la cavité péritonéale. Le traitement standard du cancer de l’ovaire repose sur une combinaison de chirurgie en centres experts (pierre angulaire du traitement, et dont la qualité a un impact direct sur la survie des patientes), de chimiothérapie et des inhibiteurs de PARP, mais de nombreux patients développent une résistance à ces traitements endéans l’année (1).
La révolution des ADC (Anticorps- Drug Conjugated) dans les cancers gynécologiques
Les ADC sont composés de trois éléments principaux : un anticorps monoclonal, une molécule cytotoxique (ou «drogue») et un lien chimique (ou linker) qui les relie. L’anticorps est conçu pour reconnaître spécifiquement une protéine, souvent une glycoprotéine, présente en abondance à la surface des cellules cancéreuses. Une fois le complexe anticorps-drogue fixé à la cellule tumorale, l’ADC est internalisé à l’intérieur de la cellule par endocytose. À l’intérieur de la cellule, le lien chimique est clivé, libérant ainsi la molécule cytotoxique qui peut alors détruire la cellule tumorale (Figure 1).
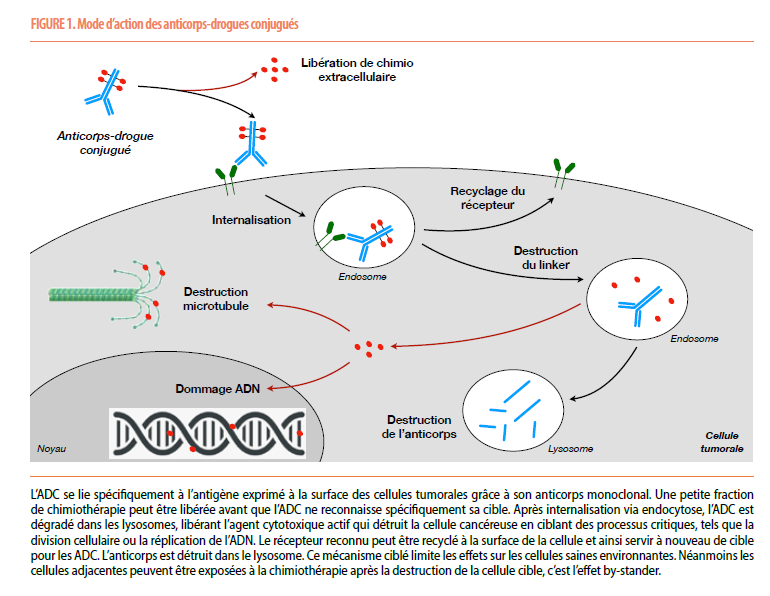
En 2024, six ADC sont disponibles pour traiter les patients oncologiques (Figure 2). Les principales toxicités des ADC sont liées soit à la drogue cytotoxique, soit à la spécificité de l’anticorps. Cette toxicité peut être modulée par la nature du linker favorisant ou pas le clivage des deux parties principales de l’ADC. Le but des chercheurs est de concevoir des liens chimiques suffisamment stables pour qu’ils ne se dégradent que dans les cellules tumorales, mais suffisamment réactifs pour libérer la drogue lorsque nécessaire. La drogue cytotoxique, qui est souvent un agent chimiothérapeutique puissant de la famille des taxanes ou de l’irinotécan, agit en inhibant des processus cellulaires essentiels, comme la division cellulaire ou la réparation de l’ADN, ce qui entraîne la mort cellulaire. Ces agents de chimiothérapie peuvent se libérer de manière prématurée ou être relargués dans l’environnement tumoral après destruction de la cellule cible. Ils vont alors affecter certaines cellules normales comme toute autre chimiothérapie conventionnelle. Dès lors, nous devons être vigilant à la neutropénie, l’anémie et la thrombocytopénie mais également à une toxicité gastro-intestinale comme des nausées, des vomissements, de la diarrhée mais aussi à l’alopécie. Les réactions d’hypersensibilité sont décrites mais elles sont rares. Une toxicité spécifique liée à la cible de l’anticorps est également possible et dépend de sa nature. Nous retiendrons principalement une alopécie, une pancytopénie, une polyneuropathie, une dermatite atopique, une kératite ophtalmologique et plus rarement une pneumopathie interstitielle pouvant être fatale.

Le Mirvetuximab Soravtansine (MIRV – Elahere®) est le premier ADC disponible pour le traitement du cancer ovarien en particulier dans les formes résistantes à une chimiothérapie à base de sels de platine. Il est dirigé contre le récepteur alpha au folate (FRα), une protéine qui est largement exprimée sur les cellules cancéreuses de l’ovaire, mais présente à des niveaux beaucoup plus faibles dans les cellules normales. Le MIRV est constitué d’un anticorps monoclonal dirigé contre le FRα, lié à une molécule cytotoxique, la DM4, qui est une forme dérivée de la maytansine, un agent chimiothérapeutique puissant. Des essais cliniques ont montré que le MIRV offre des bénéfices significatifs chez les patientes atteintes de cancer ovarien récidivant dit platine résistant. L’étude randomisée de phase III, MIRASOL a montré que 42% des patientes présentaient une réponse clinique et 5% des patientes avaient une réponse complète (2). La survie médiane sans progression était augmentée de 2 mois (médiane à 5,2 mois). Cependant, un tiers des patientes ont un bénéfice en survie globale avec une médiane passant à 16,5 mois versus 12,8 mois avec une chimiothérapie classique.
Le Trastuzumab Deruxtecan (T-DXd – Enhertu®) est un ADC qui cible le récepteur HER2 (human epidermal growth factor receptor 2), une protéine souvent surexprimée dans certains cancers. Bien que le trastuzumab deruxtecan soit plus couramment utilisé dans le traitement du cancer du sein HER2-positif, il a également montré des résultats prometteurs dans certains sous-types de cancers de l’endomètre, en particulier ceux qui surexpriment HER2. L’étude DESTINY-PanTumor02 a montré que plus de 80% des patientes atteintes de cancer de l’endomètre HER2-positif ont présenté des réponses favorables au traitement, avec une survie globale améliorée (3). Nous attendons toujours d’avoir accès à ce médicament pour nos patientes.
Le Tisotumab Vedotin (TV – Tivdak®) est un ADC ciblant le récepteur TF (Facteur Tissulaire), une protéine exprimée à la surface de nombreuses cellules tumorales, y compris celles du cancer du col de l’utérus. Le TV est composé d’un anticorps dirigé contre le TF et lié à un agent chimiothérapeutique bloquant le fuseau mitotique. L’étude ENGOT-cx12 a montré que ce traitement est efficace pour les patientes avec un cancer du col utérin métastatique ou récidivant même après une ou deux lignes de chimiothérapie (4). Trente pourcents des patientes ont une amélioration de leur survie globale, la médiane passant de 9,5 mois à 11,5 mois. Il est en cours d’approbation en Europe.
La prise en charge du cancer du col de l’utérus localement avancé
Le traitement du cancer du col localement avancé a considérablement changé en 2024. Il s’agit des patientes ayant un cancer de stade IB3 à IVA, c’est-à-dire avec une extension tumorale dépassant le col avec ou sans extension paramétriale ou ganglionnaire mais sans métastases à distance. Le traitement de ces patientes est une radiothérapie associée à une chimiothérapie sensibilisante à base de cisplatine suivi d’une curiethérapie. L’étude prospective, observationelle et multicentrique EMBRASE a montré avec un suivi médian de 51 mois qu’un tiers des patientes allaient récidiver (DFS : 68%) et qu’un quart de celles-ci mourraient de leur cancer du col endéans les 5 ans (5).
L’étude INTERLACE a démontré qu’une chimiothérapie d’induction (6 cures hebdomadaire de carboplatine et paclitaxel) administrée juste avant la radio-chimiothérapie standard améliore les résultats oncologiques (6). Le bénéfice n’est pas lié à une diminution des récidives locales qui est de 16% dans les deux groupes, ce qui est par contre le double de qui est attendu suite entre autre à une sous-utilisation de la curiethérapie. Ce bénéfice est par contre lié à une diminution des récidives à distance (20 vs 12%). Ceci se traduit par une augmentation de la survie globale des patientes à 5 ans passant de 72% pour celles recevant uniquement une radio-chimiothérapie à 80% avec l’ajout d’une courte chimiothérapie néo-adjuvante. Il est à signaler la toxicité connue de cette chimiothérapie avec entre autre une pancytopénie, une polyneuropathie, une asthénie et une alopécie réversible.
L’étude ENGOT-cx11/KEYNOTE-A18 a évalué l’ajout du pembrolizumab, un inhibiteur de PD-1, pendant la radio-chimiothérapie et en maintenance post radiothérapie pour une durée totale de traitement de 2 ans (7). La toxicité ajoutée est en lien avec le mécanisme d’action du pembrolizumab et son incidence est celle qui est attendue, à savoir qu’un patient sur 8 présente des effets auto-immuns sévères. Le suivi médian des patientes est plus court que pour l’étude INTERLACE. Néanmoins, la survie globale des patientes à 3 ans est également améliorée, passant de 75% pour celles recevant uniquement une radio-chimiothérapie à 83% avec l’ajout d’une immunothérapie.
Ces avancées soulignent l’importance des approches thérapeutiques combinées, intégrant l’immunothérapie et l’optimisation des traitements conventionnels, pour améliorer le pronostic des patientes atteintes de cette pathologie complexe. Ces deux études ne peuvent pas être comparées entre elles car elles n’ont pas inclus les mêmes types de patientes. Il y avait en effet plus de patientes avec un envahissement ganglionnaire dans l’étude ENGOT-CX11. Cependant, les conditions d’accès du pembrolizumab en Belgique ne nous permettent pas de l’utiliser chez des patientes avec des petites tumeurs ayant un envahissement ganglionnaire, mais uniquement dans les stades FIGO 2014 III-IVA (envahissement du tiers inférieur du vagin ou des parois pelviennes ou de la vessie ou du rectum).
Vers la guérison des cancers métastatiques de l’endomètre MSI/dMMR
L’immunothérapie a révolutionné le traitement des cancers, notamment pour les cancers de l’endomètre présentant une instabilité microsatellitaire (MSI) ou une déficience du système de réparation des mésappariements de l’ADN (dMMR). Ces anomalies moléculaires, présentes dans environ 25 à 30% des cancers de l’endomètre, sont associées à une forte charge mutationnelle tumorale, rendant les cellules cancéreuses particulièrement visibles pour le système immunitaire. Cela en fait des cibles idéales pour les inhibiteurs de points de contrôle immunitaire, comme les anticorps anti-PD-1 et anti-PD-L1.
L’étude randomisée de phase III NRG-GY018, a démontré l’efficacité du pembrolizumab rajouté à une chimiothérapie dans cette population spécifique (8). Le traitement par chimio-immunothérapie augmente le taux de réponse avec des réponses parfois complètes et de longue durée. Le taux de survie médiane sans progression n’est pas atteint pour ces patientes et est de 7,6 mois pour les patientes traitées avec une chimiothérapie seule (carboplatine + paclitaxel). Un bénéfice est observé chez 70% des patientes MSI/dMMR avec à un an 74% des patientes sans récidive versus 35%.
Des résultats similaires ont été observés antérieurement en 2023 avec le dostarlimab dans l’étude RUBY (9). La survie sans progression à 2 ans est de 61,4% pour les patientes recevant une chimio-immunothérapie versus 15,7% (HR=0,28). Il est à noter que la fin de la courbe de survie à partir d’un an est plate, suggérant qu’une partie de ces patientes pourraient être guéries de leur cancer métastatique. Les études randomisées de phase III AtTEnd et Duo-E, évaluant l’atézolizumab et le durvalumab respectivement, ont délivré exactement le même message (10,11).
Ces données soulignent l’importance de la caractérisation moléculaire de ces tumeurs dans le choix des stratégies thérapeutiques, ouvrant la voie à une médecine de plus en plus personnalisée et efficace. Un bénéfice chez plus de deux tiers des patientes avec un cancer de l’endomètre MSI/dMMR et des fins de courbes plates suggérent qu’une partie de ces patientes répondant à l’immunothérapie ne progressent plus et sont donc peut être guéries.
Le cancer du sein
François P Duhoux, Cédric van Marcke
Le traitement du cancer du sein est actuellement adapté en fonction de l’expression de certains récepteurs. Nous distinguons ainsi la maladie hormonosensible (ER+), les cancers HER2 positif (HER2) et les formes dites triple négatives (TN). Le pronostic des patientes atteintes d’un cancer localement avancé ou métastatique s’est amélioré grâce à des thérapies ciblées et à l’immunothérapie qui sont venues compléter les traitements classiques par chimiothérapie et hormonothérapie. En 2024, ce sont aussi les anticorps conjugués qui ont retenu toute l’attention.
Les ADC dans le cancer du sein
Le Trastuzumab Deruxtécan a encore étendu ses indications dans la maladie métastatique mammaire. Après son remboursement dans le cancer du sein HER2 positif, il a franchi cet été avec succès les étapes réglementaires pour un remboursement en Belgique dans le cancer du sein métastatique avec faible expression de HER2, après échec d’une chimiothérapie antérieure pour la maladie métastatique, grâce aux résultats de l’étude de phase 3 Destiny-Breast04, publiée en 2022. Entretemps, l’étude Destiny-Breast06, publiée en 2024, a permis de démontrer l’efficacité de ce traitement dans le cancer du sein métastatique avec expression faible ou « ultrafaible » de HER2, et ce avant tout traitement de chimiothérapie (12). Ce nouveau concept d’expression « ultrafaible » fait référence aux cancers du sein qui expriment des protéines HER2 à la surface cellulaire, mais sans que cela ne leur permette de dépasser le statut « 0 » en immunohistochimie. L’étude Destiny-Breast06 a ainsi démontré une survie sans progression médiane de 13,2 mois avec le trastuzumab déruxtécan, vs 5,1 mois avec la chimiothérapie au choix de l’investigateur (majoritairement la capécitabine ou le paclitaxel), présageant d’une mise à disposition rapide de cette molécule dans une indication encore élargie.
TROP2 est une cible d’intérêt dans le cancer du sein métastatique. Nous avons ainsi accès depuis le 1er décembre 2024 au Sacituzumab Govitécan dans une indication élargie, puisqu’il n’est dorénavant plus seulement remboursé dans le cancer du sein triple négatif, mais aussi dans le cancer du sein exprimant les récepteurs hormonaux et ne surexprimant pas HER2, après une thérapie endocrinienne et au moins deux thérapies systémiques additionnelles au stade avancé. Ce remboursement découle des résultats de l’étude TROPICS-02, qui a comparé ce traitement à une chimiothérapie au choix de l’investigateur (13). La survie sans progression s’est ainsi vue améliorée de 34%, la médiane passant de 4,0 à 5,5 mois. D’autres anticorps conjugués, tels que le datopotamab déruxtécan, ciblant aussi TROP2, ont démontré des résultats encourageants cette année, mettant à la une la question du séquençage des anticorps conjugués dans cette pathologie.
Elacestrant, une nouvelle hormonothérapie
Nous avons accès depuis peu à une nouvelle molécule ciblant le récepteur aux oestrogènes, dans le cadre d’un programme d’usage compassionnel : l’élacestrant. Ce SERD (selective estrogen receptor degrader) est particulièrement actif dans les cancers du sein hormonodépendants métastatiques qui ont développé une mutation somatique sur le gène ESR1, qui code pour le récepteur aux oestrogènes. L’étude Emerald, publiée en 2022, a ainsi démontré une augmentation de la survie sans progression chez les patientes avec mutation ESR1, en particulier lorsque le traitement préalable par hormonothérapie a été efficace pendant plus d’un an, puisque la survie sans progression médiane sous élacestrant dépasse alors 8,5 mois (14). Il s’agit donc là d’une option orale supplémentaire qui permet chez certaines patientes de retarder le moment où la chimiothérapie devient indispensable.
Le cancer de la prostate
Emmanuel Seront, Renaud Lhommel, BertrandTombal, Julien Van Damme
Le cancer de la prostate est le cancer le plus fréquent chez l’homme, surtout à partir de 50 ans. Grâce au dépistage et à des traitements adaptés, le pronostic des patients diagnostiqués tôt est excellent. Bien que sa croissance soit généralement lente, ce cancer peut métastaser dans certains cas, le rendant alors incurable. Des avancées thérapeutiques originales viennent renforcer l’arsenal thérapeutique en 2024 telles que les radioligands.
Lutecium Vipivotide Tetraxetan (177Lu-PSMA)
L’antigène spécifique de la prostate (PSMA) est une glycoprotéine transmembranaire fortement surexprimée sur les cellules tumorales prostatiques (jusqu’à 3,000x plus que sur les cellules prostatiques normales), ce qui permet un ciblage thérapeutique précis (15). La thérapie par radioligands (RLT) représente une avancée majeure pour le cancer de la prostate métastatique résistant à la castration (mCRPC). Ce traitement combine le Lutétium-177, un radioisotope émetteur de rayonnements bêta, et le ligand PSMA-617, qui en se liant au PSMA cible spécifiquement les cellules tumorales prostatiques (Figure 3). Ce radioisotope a une portée tissulaire limitée à 1-2 mm, permettant ainsi une destruction localisée des cellules cancéreuses tout en épargnant les tissus sains (16).
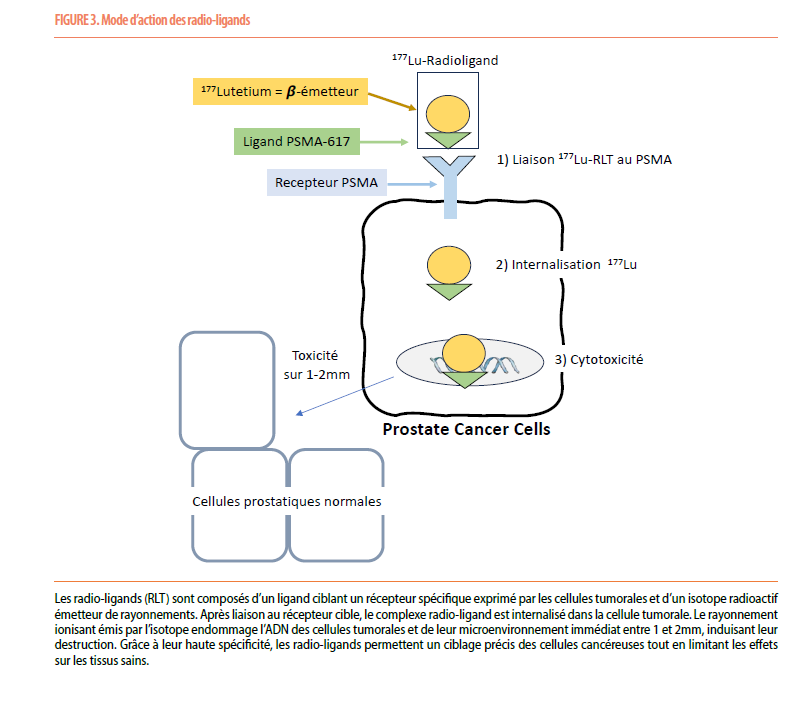
La présence du PSMA étant indispensable, il est essentiel de pouvoir identifier les patients avec une maladie néoplasique PSMA positive. Cette expression est détectée en utilisant l’imagerie par PET scan PSMA au Gallium (68Ga), qui consiste en l’injection d’un radiotraceur marqué au 68Ga, qui se fixe spécifiquement sur le PSMA. Ce PET Scan a la possibilité non seulement de mesurer l’expression du PSMA mais aussi de détecter des micro-métastases et des lésions indétectables par d’autres techniques comme le scanner, l’IRM ou la scintigraphie osseuse. Il est également intéressant de coupler ce PET-68Ga PSMA à un PET 18FDG classique afin d’exclure toute lésion métastatique présentant un « mismatch » PSMA-négative et FDG-positive, qui diminuerait les chances de réponse au 177Lu-PSMA. Enfin, le PET-68Ga PSMA permet également de suivre l’évolution de la captation du 68Ga sous traitement par 177Lu-PSMA. Le 177Lu-PSMA s’administre par voie intraveineuse sous supervision d’un médecin nucléariste. Le schéma thérapeutique recommandé de Lutétium est de 7 400 MBq toutes les 6 semaines jusqu’à un maximum de 6 doses. Une hospitalisation de 24 heures est requise. Le lendemain de l’injection, une tomographie (SPECT/CT) est réalisée afin d’obtenir des informations supplémentaires sur la distribution de l’activité administrée et le calcul des doses reçues par les lésions et par les organes à risque. Ceci permettra une adaptation ultérieure des doses de 177Lu-PSMA.
Efficacité clinique
L’efficacité du 177Lu-PSMA a été largement démontrée dans différentes études. Dans l’étude de phase III VISION, les patients atteints de mCRPc ayant progressé après hormonothérapie de nouvelle génération et chimiothérapie ont été randomisés entre : 177Lu-PSMA + traitement standard versus traitement standard seul (qui consistait en un changement d’hormonothérapie). Le 177Lu-PSMA + traitement standard, par rapport au traitement standard seul a montré une réduction du risque de progression de 60% (0.40; 95% CI 0.29 to 0.57; P<0.001) avec une amélioration significative de la survie médiane sans progression radiologique (SSPr, 8.7 vs 3.4 mois, respectivement), ainsi qu’une diminution du risque de décès de 40% (0.62; 95% CI, 0.52 to 0.74; P<0.001) avec une amélioration de la survie médiane globale (SG,15.3 vs 11.3 mois). Le 177Lu-PSMA a également montré un taux de réduction du PSA>50% (PSA50) et >80% (PSA80) plus important (46% et 33%) par rapport au traitement standard (7% et 2%) (17).
L’étude PSMAfore a exploré l’utilisation plus précoce du 177Lu-PSMA chez des patients mCRPc ayant progressé après hormonothérapie, mais sans chimiothérapie préalable. Les patients étaient randomisés entre 177Lu-PSMA et bras contrôle (changement d’hormonothérapie). Le 177Lu-PSMA a montré une amélioration de la SSPr par rapport au bras contrôle (11.6 vs 5.6 mois, respectivement); il n’y avait pas de différence significative en terme de SG entre les deux groupes en raison d’un cross-over très important (84%) du bras contrôle vers le groupe 177Lu-PSMA après progression (18).
L’étude de phase II TheraP a randomisé des patients mCRPC entre 177Lu-PSMA et chimiothérapie par cabazitaxel. Le 177Lu-PSMA a montré une réponse PSA50 supérieure à celle du cabazitaxel (66% vs 37%) et une diminution du risque de SSPr (HR 0.63, 95% CI 0.46-0.86 ; P=0.0028), bien que la survie globale soit similaire entre les deux groupes. Ceci signifie que le 177Lu-PSMA représente une alternative à la chimiothérapie par cabazitaxel en terme d’efficacité (19).
Un profil de toxicité favorable
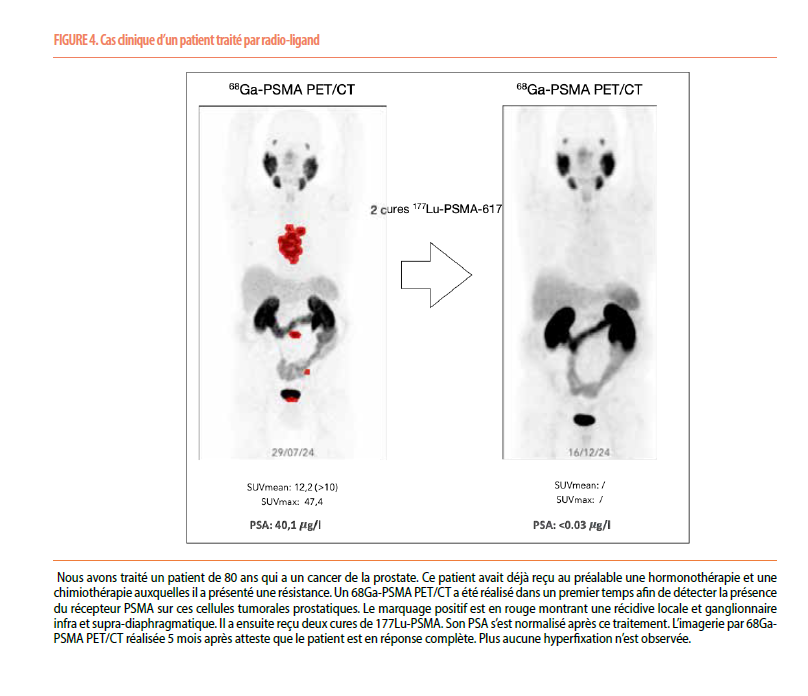
Le 177Lu-PSMA présente un profil de sécurité tout à fait positif, avec des effets secondaires bien tolérés et gérables, même chez la personne âgée (Figure 4). L’excrétion rénale du 177Lu-PSMA nécessitera une attention particulière aux patients insuffisants rénaux ou porteurs d’un seul rein, bien que l’incidence des événements indésirables rénaux reste faible. Les effets secondaires les plus fréquents sont la fatigue (tout grade=43%, grade ≥3=5%), l’anémie (tout grade=31%, grade ≥3=13%), les nausées (tout grade=35%, grade ≥3=1%) et la sécheresse buccale (tout grade=38%, grade ≥3=0%). De plus, le traitement par 177Lu-PSMA est associé à une amélioration de la qualité de vie, cette amélioration apparaissant dès le deuxième cycle (3-5).
Perspective future
L’intégration du 177Lu-PSMA avec d’autres traitements, tels que les hormonothérapies de nouvelle génération, les inhibiteurs de PARP, les immunothérapies et les agents de chimiothérapie, fait actuellement l’objet de recherches cliniques prometteuses. Ces associations ont pour objectif d’optimiser l’efficacité thérapeutique tout en limitant les risques de résistance. Par ailleurs, d’autres radioisotopes, tels que l’Actinium 225 (225Ac), font l’objet d’investigations dans le traitement du cancer de la prostate. L’efficacité du 177Lu-PSMA est également évaluée de manière plus précoce dans le cadre de la prise en charge de cette pathologie, avec plusieurs études en cours dans notre centre. Enfin, des recherches explorent l’expression du PSMA dans d’autres types de tumeurs, notamment le cancer du rein métastatique. Nous avons déjà démontré que le PSMA est exprimé sur les vaisseaux tumoraux irriguant le cancer du rein, ce qui en fait une cible prometteuse pour le 177Lu-PSMA. Cela suggère une applicabilité potentielle plus large de cette approche en oncologie (20).
Les mélanomes
Jean-François Baurain, Frank Cornélis, Paulina Bartoszek
Le mélanome cutané est devenu le cinquième cancer le plus fréquent en Belgique tous sexes confondus. Son incidence continue de doubler tous les 10 ans. Heureusement, 70% des patients sont guéris avec une simple chirurgie. Les facteurs de risques de récidive sont un indice de Breslow élevé, une ulcération de la tumeur primitive ou un envahissement ganglionnaire. Ce risque de récidive peut être diminué chez près d’un tiers des patients grâce à un traitement adjuvant d’immunothérapie d’un an avec le nivolumab ou le pembrolizumab (anti-PD-1). Un bénéfice similaire a été observé avec des thérapies ciblées bloquant les protéines BRAF et MEK chez les patients atteints d’un mélanome à haut risque de rechute arborant la mutation BRAF V600E.
Le traitement de la maladie métastatique
L’administration d’une immunothérapie est le traitement de première intention pour les patients atteints d’un mélanome métastatique. Avec dix ans de recul sur les résultats des premiers essais cliniques comparant les anticorps anti-PD1 avec la chimiothérapie ou l’ipilimumab (anti-CTLA-4), nous pouvons affirmer que nous guérissons un grand nombre de patients avec un mélanome cutané métastatique. En analysant les courbes de survie de ces études, nous observons un plateau après quelques mois ; c’est-à dire que plus aucun patients ne décède. Ceci suggère voire démontre que ces patients ont été guéris de leur cancer métastatique. Dans les deux grandes études de phase III randomisées KEYNOTE-006 et CHECKMATE-067, plus de 40% des patients traités avec le pembrolizumab ou le nivolumab sont encore en vie à 10 ans alors qu’avec la chimiothérapie leur médiane de survie était de 6 mois avec quelques rares patients encore en vie à 5 ans (21,22). Si nous combinons les anticorps anti PD-1 et anti CTLA-4, la moitié des patients est encore en vie à 60 mois. C’est mieux, néanmoins la combinaison est plus toxique. La moitié des patients vont être hospitalisés pour des toxicités auto-immunes sévères au lieu d’un patient sur 8 avec un anti-PD-1 seul. Nous réservons la combinaison nivolumab et ipilimumab aux patients présentant un mélanome muté BRAF. Dans ce sous-groupe de patients, le bénéfice clinique de la combinaison est supérieur à la monothérapie en terme de taux de réponse, de survie sans progression et de survie globale, ce qui n’est pas le cas dans le sous-groupe BRAF non muté où seul le taux de réponse est plus important. Néanmoins, les patients non mutés ayant des métastases cérébrales asymptomatiques (sans corticothérapie) ont besoin d’avoir une diminution rapide de leur maladie cérébrale. Il a été observé dans plusieurs études que le taux de réponse de la maladie cérébrale est équivalent à la maladie extracérébrale avec la combinaison nivolumab et ipilimumab.
En 2024, nous avons maintenant accès à une autre combinaison (Opdualag®) moins toxique que la combinaison nivolumab et ipilimumab et plus efficace que le nivolumab en monothérapie. Il s’agit de la combinaison du nivolumab et du relatlimab, un anticorps contre le récepteur LAG-3, un autre frein sur les lymphocytes T cytolytiques. L’étude RELATIVITY a montré que 22% des patients métastatiques ont une survie sans progression augmentée, leur médiane de survie étant de 10,2 mois avec la combinaison comparée à 4,6 mois avec le nivolumab seul. Le taux de réponse augmente de 10% (43 vs 33%). Un patient sur quatre va présenter une toxicité auto-immune sévère. En décembre 2024, les résultats de la survie globale ont été publiés (23). La survie globale médiane des patients recevant cette combinaison est de 51 mois versus 34 mois avec la monothérapie. La combinaison de nivolumab et de relatlimab est proposée en Belgique uniquement pour les patients métastatiques ayant un mélanome n’exprimant pas le PD-L1 comme première ligne de traitement.
Le traitement néo-adjuvant du mélanome cutané
Le traitement des patients avec un mélanome cutané ayant déjà un envahissement clinique des ganglions de drainage est une chirurgie de curage ganglionnaire et un an d’immunothérapie adjuvante. Malheureusement, un peu moins de la moitié de ces patients à haut risque va présenter une récidive parfois endéans les 6 mois de la fin de ces traitements. Plusieurs études dont l’étude académique randomisée de phase III NADINA ont montré que l’administration de seulement deux cures de nivolumab et d’ipilimumab avant la chirurgie permet d’obtenir une réponse pathologique quasi complète chez deux tiers des patients (24). Avec un recul d’un peu plus de deux ans, nous observons que la quasi-totalité de ces patients répondeurs ne vont pas récidiver et donc pourraient être guéris de leur mélanome sans traitement adjuvant après la chirurgie. Un gain d’efficacité associé à une diminution de la toxicité pour le patient et à un coût nettement moindre pour la société. C’est une révolution !
L’approche par immunothérapie néo-adjuvante est devenue en 2024 le traitement de référence pour les patients atteints d’un mélanome cutané avec un envahissement ganglionnaire clinique. Cette stratégie est également proposée dans le cadre d’études cliniques dans de nombreux autres cancers. Par exemple, dans le cancer du rectum MSI positif, tous les patients ayant reçu une immunothérapie néo-adjuvante ont eu une réponse complète et n’ont pas subi d’opération mutilante, ni de radiochimiothérapie (25). L’avantage du traitement néo-adjuvant réside dans sa capacité à attaquer les cellules cancéreuses plus tôt, donc dans un environnement avec moins de résistance immunitaire. De plus, tous les lymphocytes anti-tumoraux peuvent être réactivés et donc préserver les plus grands réservoirs de ces lymphocytes au niveau de la tumeur et des ganglions de drainage qui n’ont pas été retirés par la chirurgie, permet une meilleure réponse immunologique. Tout cela démontre que juste en changeant le moment du traitement, nous pouvons améliorer le pronostic des patients en prévenant de manière plus efficace la dissémination métastatique et faciliter la chirurgie ou la rendre superflue !
Des nouveautés dans le mélanome oculaire
Le mélanome oculaire, bien que moins fréquent que le mélanome cutané, est la forme la plus courante de cancer intraoculaire primitif chez l’adulte. Le traitement de la tumeur oculaire par brachythérapie ou énucléation est très efficace avec plus de 90% de contrôle local mais environ la moitié des patients présente déjà au moment du traitement oculaire des micrométastases non détectables, la plupart du temps dans le foie. Celles-ci vont être responsables de récidive systémique, parfois plusieurs années plus tard. Si la récidive est localisée exclusivement au niveau du foie et qu’il n’y a que quelques lésions, alors un traitement local par radiofréquence ou par SIRsphère® peut être proposé. Cette situation clinique est malheureusement rare car la plupart du temps la récidive est floride. Le traitement est alors une immunothérapie avec le nivolumab ou le pembrolizumab. Cependant, l’efficacité de ces anticorps dans le mélanome uvéal est nettement inférieure à celle observée dans le mélanome cutané avec une médiane de survie des patients de 18 mois. La combinaison de nivolumab et d’ipilimumab a montré des réponses plus importantes mais sans augmentation de survie. Dans une revue récente des données, il a été montré que seul les patients ayant des métastases pulmonaires ont un bénéfice à recevoir la combinaison au lieu de la monothérapie. Le tebentafusp (Kimmtrak®) est un « bispecific T-cell engager » (BiTE), une classe de médicaments qui fonctionne en dirigeant spécifiquement les cellules T du système immunitaire vers les cellules tumorales. Plus précisément, il lie à la fois le récepteur CD3 des cellules T et un antigène spécifique des mélanocytes appelé gp100 présenté par les molécules HLA-A2, qui est exprimé sur la surface des cellules du mélanome. Sa toxicité est marginale, le taux de réponse est anecdotique mais il augmente de plus de 6 mois la survie médiane des patients métastatiques HLA-A2 (26). Prochainement, il va être testé comme traitement adjuvant pour les patients traités de leur tumeur oculaire primitive présentant des caractéristiques de haut risque de récidive métastatique.
Références
- Luyckx M, Jouret M, Sawadogo K, Waterkeyn M, Grandjean F, Van Gossum JP, et al. Centralizing surgery for ovarian cancer in a ’non-centralizing’ country (Belgium): the UNGO (UCLouvain Network of Gynaecological Oncology) experience. Int J Gynecol Cancer. 2024 Jan 5;34(1):106-112. doi: 10.1136/ijgc-2023-004401.
- Moore KN, Angelergues A, Konecny GE, García Y, Banerjee S, Lorusso D, et al; Gynecologic Oncology Group Partners and the European Network of Gynaecological Oncological Trial Groups. Mirvetuximab Soravtansine in FRalpha-Positive, Platinum-Resistant Ovarian Cancer. N Engl J Med. 2023 Dec 7;389(23):2162-2174. doi: 10.1056/NEJMoa2309169.
- Meric-Bernstam F, Makker V, Oaknin A, Oh DY, Banerjee S, González-Martín A, et al. Efficacy and Safety of Trastuzumab Deruxtecan in Patients With HER2-Expressing Solid Tumors: Primary Results From the DESTINY-PanTumor02 Phase II Trial. J Clin Oncol. 2024 Jan 1;42(1):47-58. doi: 10.1200/JCO.23.02005.
- Vergote I, González-Martín A, Fujiwara K, Kalbacher E, Bagaméri A, Ghamande S, et al; innovaTV 301/ENGOT-cx12/GOG-3057 Collaborators. Tisotumab Vedotin as Second- or Third-Line Therapy for Recurrent Cervical Cancer. N Engl J Med. 2024 Jul 4;391(1):44-55. doi: 10.1056/NEJMoa2313811.
- Pötter R, Tanderup K, Schmid MP, Jürgenliemk-Schulz I, Haie-Meder C, Fokdal LU, et al; EMBRACE Collaborative Group. MRI-guided adaptive brachytherapy in locally advanced cervical cancer (EMBRACE-I): a multicentre prospective cohort study. Lancet Oncol. 2021 Apr;22(4):538-547. doi: 10.1016/S1470-2045(20)30753-1.
- McCormack M, Eminowicz G, Gallardo D, Diez P, Farrelly L, Kent C, et al; INTERLACE investigators. Induction chemotherapy followed by standard chemoradiotherapy versus standard chemoradiotherapy alone in patients with locally advanced cervical cancer (GCIG INTERLACE): an international, multicentre, randomised phase 3 trial. Lancet. 2024 Oct 19;404(10462):1525-1535. doi: 10.1016/S0140-6736(24)01438-7.
- Lorusso D, Xiang Y, Hasegawa K, Scambia G, Leiva M, Ramos-Elias P, et al.; ENGOT-cx11/GOG-3047/KEYNOTE-A18 investigators. Pembrolizumab or placebo with chemoradiotherapy followed by pembrolizumab or placebo for newly diagnosed, high-risk, locally advanced cervical cancer (ENGOT-cx11/GOG-3047/KEYNOTE-A18): a randomised, double-blind, phase 3 clinical trial. Lancet. 2024 Apr 6;403(10434):1341-1350. doi: 10.1016/S0140-6736(24)00317-9.
- Eskander RN, Sill MW, Beffa L, Moore RG, Hope JM, Musa FB, et al. Pembrolizumab plus Chemotherapy in Advanced Endometrial Cancer. N Engl J Med. 2023 Jun 8;388(23):2159-2170. doi: 10.1056/NEJMoa2302312.
- Powell MA, Bjørge L, Willmott L, Novák Z, Black D, Gilbert L et al. Overall survival in patients with endometrial cancer treated with dostarlimab plus carboplatin-paclitaxel in the randomized ENGOT-EN6/GOG-3031/RUBY trial. Ann Oncol. 2024 Aug;35(8):728-738. doi: 10.1016/j.annonc.2024.05.546.
- Colombo N, Biagioli E, Harano K, Galli F, Hudson E, Antill Y, et al.; AtTEnd study group. Atezolizumab and chemotherapy for advanced or recurrent endometrial cancer (AtTEnd): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2024 Sep;25(9):1135-1146. doi: 10.1016/S1470-2045(24)00334-6.
- Westin SN, Moore K, Chon HS, Lee JY, Thomes Pepin J, Sundborg M, et al.; DUO-E Investigators. Durvalumab Plus Carboplatin/Paclitaxel Followed by Maintenance Durvalumab With or Without Olaparib as First-Line Treatment for Advanced Endometrial Cancer: The Phase III DUO-E Trial. J Clin Oncol. 2024 Jan 20;42(3):283-299. doi: 10.1200/JCO.23.02132.
- Bardia A, Hu X, Dent R, Yonemori K, Barrios CH, O’Shaughnessy JA, et al.; DESTINY-Breast06 Trial Investigators. Trastuzumab Deruxtecan after Endocrine Therapy in Metastatic Breast Cancer. N Engl J Med. 2024 Dec 5;391(22):2110-2122. doi: 10.1056/NEJMoa2407086.
- Rugo HS, Bardia A, Marmé F, Cortés J, Schmid P, Loirat D, et al. Overall survival with sacituzumab govitecan in hormone receptor-positive and human epidermal growth factor receptor 2-negative metastatic breast cancer (TROPiCS-02): a randomised, open-label, multicentre, phase 3 trial. Lancet. 2023 Oct 21;402(10411):1423-1433. doi: 10.1016/S0140-6736(23)01245-X.
- Bardia A, Cortés J, Bidard FC, Neven P, Garcia-Sáenz J, Aftimos P, et al. Elacestrant in ER+, HER2- Metastatic Breast Cancer with ESR1-Mutated Tumors: Subgroup Analyses from the Phase III EMERALD Trial by Prior Duration of Endocrine Therapy plus CDK4/6 Inhibitor and in Clinical Subgroups. Clin Cancer Res. 2024 Oct 1;30(19):4299-4309. doi: 10.1158/1078-0432.
- Vlachostergios PJ, Niaz MJ, Sun M, Mosallaie SA, Thomas C, Christos PJ, et al. Prostate-Specific Membrane Antigen Uptake and Survival in Metastatic Castration-Resistant Prostate Cancer. Front Oncol. 2021 Feb 18;11:630589. doi: 10.3389/fonc.2021.630589.
- Violet J, Jackson P, Ferdinandus J, Sandhu S, Akhurst T, Iravani A et al. Dosimetry of (177)Lu-PSMA-617 in Metastatic Castration-Resistant Prostate Cancer: Correlations Between Pretherapeutic Imaging and Whole-Body Tumor Dosimetry with Treatment Outcomes. J Nucl Med. 2019 Apr;60(4):517-523. doi: 10.2967/jnumed.118.219352.
- Sartor O, de Bono J, Chi KN, Fizazi K, Herrmann K, Rahbar K, et al.; VISION Investigators. Lutetium-177-PSMA-617 for Metastatic Castration-Resistant Prostate Cancer. N Engl J Med. 2021 Sep 16;385(12):1091-1103. doi: 10.1056/NEJMoa2107322.
- Morris MJ, Castellano D, Herrmann K, de Bono JS, Shore ND, Chi KN et al.; PSMAfore Investigators. (177)Lu-PSMA-617 versus a change of androgen receptor pathway inhibitor therapy for taxane-naive patients with progressive metastatic castration-resistant prostate cancer (PSMAfore): a phase 3, randomised, controlled trial. Lancet. 2024 Sep 28;404(10459):1227-1239. doi: 10.1016/S0140-6736(24)01653-2.
- Hofman MS, Emmett L, Sandhu S, Iravani A, Joshua AM, Goh JC, et al.; TheraP Trial Investigators and the Australian and New Zealand Urogenital and Prostate Cancer Trials Group. [(177)Lu]Lu-PSMA-617 versus cabazitaxel in patients with metastatic castration-resistant prostate cancer (TheraP): a randomised, open-label, phase 2 trial. Lancet. 2021 Feb 27;397(10276):797-804. doi: 10.1016/S0140-6736(21)00237-3.
- Seront E, Reichel C, Lhommel R, Tombal B. A Case Series Study of the Role of Prostate-specific Membrane Antigen Positron Emission Tomography/Computed Tomography in Early Evaluation of the Response to Systemic Therapy in Metastatic Renal Cancer. Eur Urol Oncol. 2024 Oct;7(5):1147-1149. doi: 10.1016/j.euo.2024.02.006.
- Long GV, Carlino MS, McNeil C, Ribas A, Gaudy-Marqueste C, Schachter J, et al. Pembrolizumab versus ipilimumab for advanced melanoma: 10-year follow-up of the phase III KEYNOTE-006 study. Ann Oncol. 2024 Dec;35(12):1191-1199. doi: 10.1016/j.annonc.2024.08.2330.
- Wolchok JD, Chiarion-Sileni V, Rutkowski P, Cowey CL, Schadendorf D, Wagstaff J et al.; CheckMate 067 Investigators. Final, 10-Year Outcomes with Nivolumab plus Ipilimumab in Advanced Melanoma. N Engl J Med. 2025 Jan 2;392(1):11-22. doi: 10.1056/NEJMoa2407417.
- Tawbi HA, Hodi FS, Lipson EJ, Schadendorf D, Ascierto PA, Matamala L, et al. Three-Year Overall Survival With Nivolumab Plus Relatlimab in Advanced Melanoma From RELATIVITY-047. J Clin Oncol. 2024 Dec 13:JCO2401124. doi: 10.1200/JCO.24.01124.
- Blank CU, Lucas MW, Scolyer RA, van de Wiel BA, Menzies AM, Lopez-Yurda M, et al. Neoadjuvant Nivolumab and Ipilimumab in Resectable Stage III Melanoma. N Engl J Med. 2024 Nov 7;391(18):1696-1708. doi: 10.1056/NEJMoa2402604.
- Cercek A, Lumish M, Sinopoli J, Weiss J, Shia J, Lamendola-Essel M et al.. PD-1 Blockade in Mismatch Repair-Deficient, Locally Advanced Rectal Cancer. N Engl J Med. 2022 Jun 23;386(25):2363-2376. doi: 10.1056/NEJMoa2201445.
- Hassel JC, Piperno-Neumann S, Rutkowski P, Baurain JF, Schlaak M, Butler MO, et al. Three-Year Overall Survival with Tebentafusp in Metastatic Uveal Melanoma. N Engl J Med. 2023 Dec 14;389(24):2256-2266. doi: 10.1056/NEJMoa2304753.
Affiliations
Cliniques universitaires Saint-Luc, B-1200 Bruxelles
1. Oncologie médicale
2. Gynécologie et d’andrologie
3. Médecine nucléaire
4. Urologie
5. Ophtalmologie
Correspondance
Pr Jean-François Baurain
Cliniques universitaires Saint-Luc - UCLouvain
Oncologie médicale
Avenue Hippocrate 10
B-1200 Bruxelles