INTRODUCTION
L’engorgement des services d’urgences est l’une des principales problématiques de santé publique rencontrées dans ce secteur au cours de la dernière décennie.
Son étiologie est multifactorielle (1): l’augmentation du volume d’admission de patients, la pénurie de personnel médical et infirmier, l’augmentation de la complexité de la gestion des patients, la diminution de capacité de certains hôpitaux, etc…
À ceci s’ajoute la problématique du déficit budgétaire, obligeant à soigner plus de patients avec moins de moyens tout en restant aussi performant et compétent.
Face à ce nombre de patients en perpétuelle croissance, la priorité des urgentistes est de détecter rapidement les patients graves nécessitant des soins immédiats, et ceux à faible risque de complications pouvant quitter le service, voire l’hôpital plus rapidement. L’une des solutions pour l’identification de ces sous-groupes de patients et une prise en charge efficiente réside dans l’utilisation des biomarqueurs (2).
La mesure et l’étude des biomarqueurs recouvrent une grande variété d’applications médicales:
- le dépistage oncologique: CEA, CA 19.9 … ;
- le diagnostic d’une pathologie: ex : troponine dans le syndrome coronaire aigu ;
- l’exclusion d’une pathologie: ex: d-dimères dans la maladie thromboembolique ;
- la stratification de la maladie ou de la réponse au traitement: ex: le lactate dans le sepsis ou le PSA dans le cancer de la prostate.
Ils ont l’avantage d’être accessibles par un test sanguin simple, parfois même au lit du patient (“bedside”). Cette facilité peut néanmoins entrainer le risque d’utilisations inadaptées en suscitant des explorations complémentaires inutiles, parfois même délétères pour le patient, rappelant la nécessité de ne les doser que dans le cadre d’une suspicion clinique et d’une démarche diagnostique.
Dans cette revue, nous nous intéresserons à la place de la P S100β dans la prise en charge du traumatisme crânien léger aux urgences. Cette indication est la plus connue mais la P S100β semble aussi occuper une place intéressante dans le pronostic neurologique après un arrêt cardiaque (3) ou un accident vasculaire cérébral de type ischémique et hémorragique(4); lors des pathologies type encéphalopathie (5), du choc et du sepsis au sens large (6).
PHYSIOPATHOLOGIE
La P S100β est une protéine intracellulaire régulant la disponibilité cytosolique du calcium. C’est une holoprotéine dimérique de 21kDa constituée soit de deux sous-unités β (monodimère) soit d’une sous-unité β et une sous-unité α (hétérodimère). Son nom lui vient de son excellente solubilité (à 100%) dans une solution saturée de sulfate d’ammonium à pH neutre.
La sous unité β lui confère sa spécificité cérébrale car elle est synthétisée principalement au niveau cérébral par les cellules astrogliales et les cellules de la gaine de Schwann au niveau de la moelle épinière, mais aussi par le cervelet, certaines cellules neuronales des substances blanche et grise. Elle est plus faiblement synthétisée, (30 à 100 fois moins) par des cellules extra-cérébrales comme les cellules dendritiques, les mélanocytes, les cellules de la moelle osseuse, les adipocytes, les chondrocytes, les lymphocytes, les cellules de Langerhans et certaines fibres musculaires.
La sous unité β exerce une activité autocrine en participant à la forme cellulaire ainsi qu’à la régulation de la prolifération et de la différentiation cellulaire. Elle exerce aussi une activité paracrine sur les astrocytes et les neurones adjacents, les adipocytes et d’autres types cellulaires en exerçant des fonctions de maintien de l’intégrité fonctionnelle et de développement du tissu cérébral par effet de croissance, de survie et d’apoptose. La libération de la PS100β est observée lors de lésions cérébrales d’origine vasculaire ou traumatique, suscitant un intérêt clinique majeur.
Son intérêt clinique et biologique est également à l’étude dans les situations de surexpressions de son gène (comme la Trisomie 21, le Creutzfzeldt-Jacob, la maladie d’Alzheimer, la sclérose en plaque ou encore dans le mélanome malin).
L’augmentation de concentration de la PS100β après une interruption (complète ou partielle) du flux sanguin lors d’un bas débit cérébral ou d’un traumatisme crânien, serait causée par un œdème cérébral diffus qui entraine la mort de la population cellulaire cérébrale la plus vulnérable à l’hypoxie, les cellules astrogliales (7). Cela engendre une altération de l’intégrité de leur membrane cellulaire et de la barrière hémato-encéphalique et mène au relargage de PS100β vers le compartiment extra cellulaire avec une fuite du fluide cérébrospinal vers la circulation sanguine. Le second mécanisme de l’ischémie consiste en des lésions de reperfusion contribuant aux dommages cérébraux via la génération de radicaux libres et de médiateurs inflammatoires (8).
La PS100β est présente de façon physiologique au niveau cérébral à une concentration de l’ordre de 1-2µg/L et de 0.02 à 0.1µg/L au niveau plasmatique. Le dosage du biomarqueur se réalise sur le sérum à partir d’un prélèvement veineux. C’est une molécule très stable car l’échantillon sanguin peut être conservé à des températures allant de +4°C à -80°C (9) pour des périodes allant respectivement de 48h à plusieurs mois sans interférence sur le dosage analytique et ce même en cas d’échantillon hémolysé. La détection et la mesure de la concentration de la protéine en milieux biologiques sont réalisées par immunodosage utilisant un mélange d’anticorps monoclonaux dirigé contre la sous unité β.
Le seuil de positivité sanguin de cette protéine varie dans la littérature entre 0.1µg/L à 0.15µg/L selon :
- la méthode de détection utilisée (immuno-radiométrie, -luminométrie, -absorbance…) ;
- la machine utilisée (Diasorin ®, Roche ®, Sangtec ®…) ;
- la production endogène naturelle de la protéine via les mélanocytes (les patients à peau foncée ou noire ont un taux plus élevé suite à une production cutanée accrue) (10) ;
- selon la fonction rénale du patient.
Le dosage est obtenu aux urgences en 1 à 2 h selon la technique. La demi-vie plasmatique est de l’ordre de 30-90 min et son élimination se fait par voie rénale.
À la lumière de la littérature, nous analyserons la pertinence et la fiabilité des informations apportées par ce biomarqueur afin de déterminer la place de la P S100β dans la prise en charge des patients avec un traumatisme crânien mineur aux urgences.
LE TRAUMATISME CRÂNIEN MINEUR
Le traumatisme crânien mineur est un motif d’admission quotidien aux urgences. Il représente 71-98% de l’ensemble des traumatismes crâniens en Europe. Avec une incidence annuelle de 262 cas pour 100 000 habitants (11), le traumatisme crânien en général représente également l’une des causes significatives de morbidité et de mortalité chez l’adulte, et est l’une des principales causes de décès dans le traumatisme chez l’enfant.
L’évaluation clinique et neurologique du patient, afin de déceler des lésions cérébrales, sont parfois difficiles au vu entre autre du nombre important d’intoxications associées (alcool, drogues...). La tomographie cérébrale représente l’examen de référence pour la détection de ces lésions. Dans les catégories des traumatismes crâniens modérés (Glasgow Coma Scale (GCS) 9-13/15 avec signes neurologiques focaux) et sévères (GCS <8/15) la réalisation d’une tomographie cérébrale ne se discute pas. Ce qui ne semble pas être le cas pour les traumatismes crâniens mineurs, puisque les complications graves secondaires à ces traumatismes légers sont rares avec seulement 8% de lésions à la tomographie dont moins d’1% nécessitent une prise en charge neurochirurgicale (12). Le taux de mortalité suite à un traumatisme crânien mineur se situe entre 0,9 à 7,6 %, contre 29 à 55% en cas de traumatisme sévère (11).
Vu le risque accru de cancer lié aux irradiations, en particulier chez l’enfant et les jeunes adultes, le coût, l’accessibilité parfois limitée de la tomographie dans certaines régions durant la nuit et les week-ends et le nombre important de scanners négatifs, Il existe un besoin et une volonté d’identifier les patients à faible risque de complications afin de limiter la réalisation de scanner chez les patients ayant subi un traumatisme crânien mineur.
Ces quinze dernières années, plusieurs règles et recommandations ont été établies afin de permettre une classification reproductible du traumatisme crânien en 3 catégories : mineur, modéré, sévère et de guider et optimaliser leur prise en charge et le recours à la tomographie : les “New Orleans Rules”(13) paru en 2000, “Canadian CT rules”(12) paru en 2001, “Scandinavian Neurotrauma Committee guidelines”(14), parues en 2013 et révisées en 2015, analysant et détaillant l’intérêt du dosage de la P S100β dans la démarche clinique (15). Le traumatisme crânien mineur y est défini comme un coup sur la tête ou une rapide accélération/décélération ayant comme résultat l’un des symptômes suivants :
- une perte de conscience de moins de 30 min ;
- une amnésie post traumatique de moins de 24 h ;
- un comportement neuropsychologique anormal: toute période transitoire de confusion, une désorientation, une altération de la conscience, un score entre 14 et 15 sur l’échelle de Glasgow après le traumatisme ;
- une anomalie ou signes neurologiques focaux transitoires: convulsion post traumatique, hémiplégie, diplopie, …
Ces recommandations intègrent de nombreux travaux réalisés sur l’utilité clinique de la P S100β dans cette indication.
Dans le courant l’année 1995, on voit apparaitre un intérêt grandissant des équipes de neurologie pour la P S100β comme molécule de régulation cellulaire cérébrale et c’est également cette année-là qu’une première étude suggère l’intérêt potentiel de la P S100β dans le traumatisme crânien mineur (16).
C’est à la fin des années 1990 et au début des années 2000, que ce biomarqueur prend une importance grandissante dans la prise en charge du traumatisme crânien mineur isolé. Mais les résultats sont obtenus sur de petites cohortes de patients, ce qui limite leur généralisation.
En 2006, Biberthaler et al. (17) confirment l’intérêt de cette protéine avec une cohorte observationnelle de 1309 patients victimes d’un traumatisme crânien mineur. Un dosage de la P S100β et une tomographie cérébrale sont effectués chez chaque patient afin d’évaluer la valeur du dosage. La détection de lésions cérébrales par le dosage de la protéine montre une sensibilité de 99% avec un intervalle de confiance à 95% (IC) entre 96-100%, une spécificité de 30% (IC: 29-31%) et une valeur prédictive négative de 99,7% (IC : 99-100%). D’autres grandes études confirment ces résultats, notamment l’étude de Zongo et al. (18) en 2010 avec une cohorte de 1560 patients, Calcagnile et al. en 2012 (19) sur une cohorte de 512 patients (en terme de sensibilité mais avec un IC entre 83-100%). Le tableau 1 résume les performances de la PS100B retrouvées dans l’ensemble des travaux publiés cités.
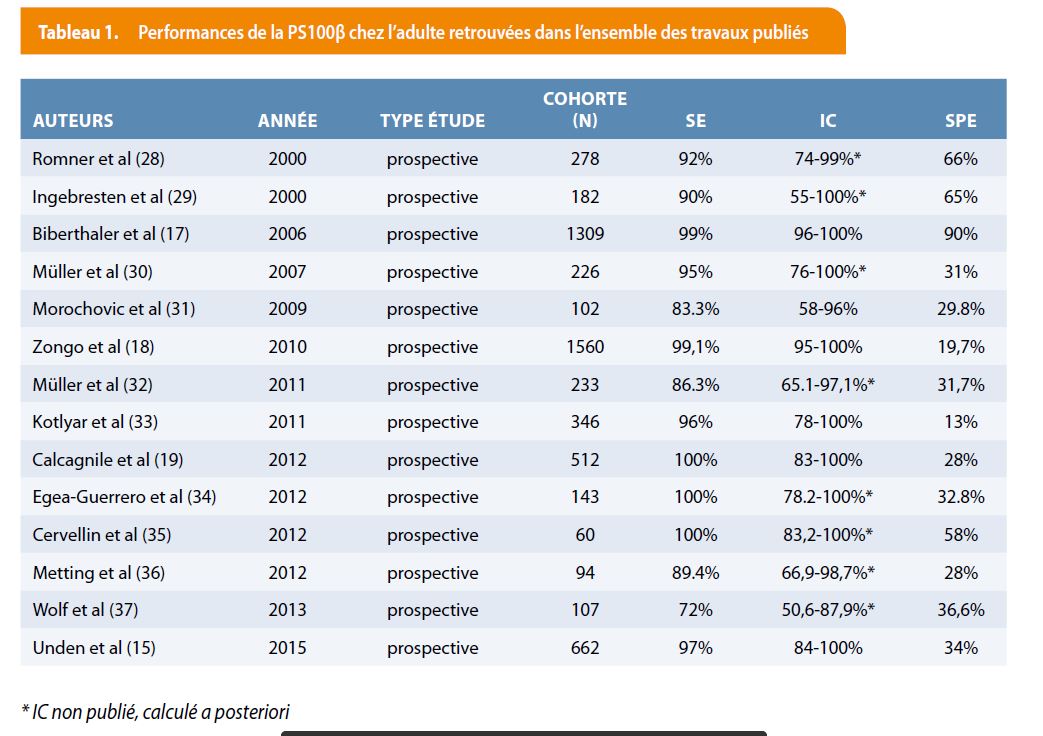
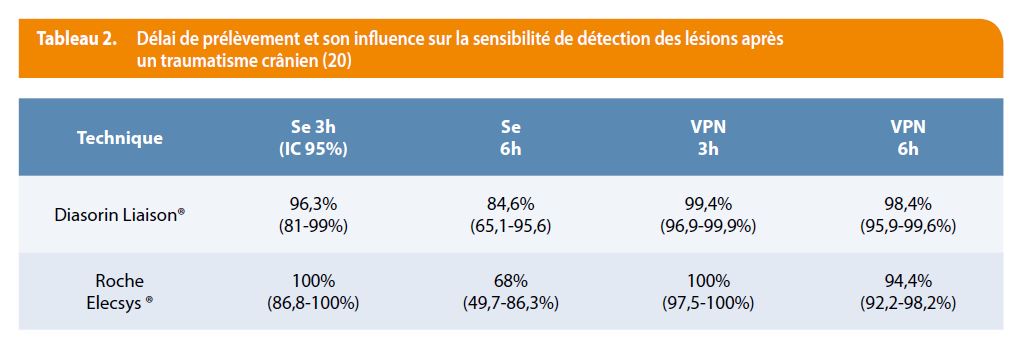
De même, Laribi et al. en 2013 (20) sur base d’une étude multicentrique de 431 patients confirment une bonne sensibilité, spécificité et une valeur prédictive négative proche des 100% (IC 96.9-99.9%). Ces derniers apportent cependant une nuance quant au délai de prélèvement de l’échantillon en comparant la sensibilité de détection de lésion à 3h et à 6h du traumatisme crânien. Il démontre que le meilleur taux de détection est obtenu lorsque le prélèvement est réalisé dans les 3 heures du traumatisme aussi bien avec la méthode Roche Elecsys® (seuil 0.10 µg/L) que Diasorin Liaison® (seuil 0.15 µg/L) avec une sensibilité respective de 100% et 96,3% avec un IC de 86,8-100% et une valeur prédictive négative respective de 100% et 99,4% avec un IC respectivement entre 97,5-100% et 96,9-99,9%. Ces valeurs diminuent respectivement à 84,6% et 98.4% à 6h du traumatisme pour les mêmes seuils de détection en utilisant la méthode de Diasorin Liaison® et sont encore moins bonnes en utilisant la technique de Roche Elecsys® avec une sensibilité à 68% et une valeur prédictive négative à 94,4%. Un dosage tardif ou un second dosage n’est donc pas contributif dans la prise en charge du patient. Le tableau 2 résume les résultats obtenus selon le délai de prélèvement.
En 2016, le KCE (21) publie une revue de littérature sur l’utilisation de la PS100β dans le traumatisme crânien mineur et met en avant la relativement bonne sensibilité de la protéine quant à l’exclusion des lésions cérébrales chez l’adulte mais conclut en soulignant l’importance de la réalisation d’une étude prospective sur l’utilisation de la protéine dans la pratique clinique quotidienne afin de savoir si les données des différentes études peuvent être représentatives et extrapolables à la situation globale en Belgique. Cette conclusion prudente est basée sur l’étendue des IC des sensibilités des différentes études à notre disposition. Sur le plan économique (22), l’utilisation courante du dosage de la protéine permettrait une diminution potentielle d’environ 25-30% du nombre de tomographies actuellement réalisées, et même jusqu’à 41% selon l’étude de Laribi et al, ainsi que du coût hospitalier engendré par une surveillance de 24h des patients ainsi qu’une diminution du temps d’observation et d’occupation des lits dans les services d’urgences.
CAS PARTICULIERS
1. Le patient intoxiqué (alcool)
Dans 20 à 30% des cas, les admissions aux urgences pour traumatisme crânien sont associées à une intoxication. L’examen clinique des patients est d’autant plus difficile que leur niveau d’intoxication fausse l’évaluation neurologique et la gravité de leurs lésions. Il a déjà été démontré que la consommation chronique et abusive d’alcool induit, à moyen terme, une dégénérescence des cellules cérébrales. Il est donc légitime de s’interroger quant à la fiabilité du dosage de ce biomarqueur, lui-même produit d’une lyse cellulaire cérébrale, pour la détection des lésions cérébrales post traumatique chez ces patients.
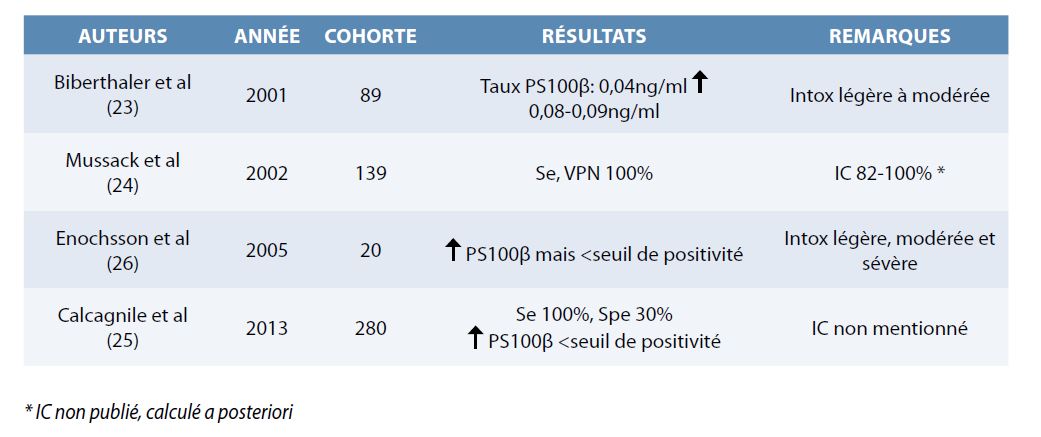
En 2001, Biberthaler, Mussack et al. (23) comparent le taux de P S100β chez 89 patients divisés en deux groupes : patients sobres et les patients sous influence de l’alcool, avec ou sans traumatisme crânien. Les résultats obtenus sont peu convaincants et contradictoires quant à l’absence de différences du taux de la protéine chez ces deux groupes de patients.
En 2002, une nouvelle étude du même groupe montre chez des patients sous influence d’alcool et ayant un TCMin=139), une sensibilité de 100% et une spécificité de 50% de la protéine quel que soit le degré d’intoxication (légère, modérée ou sévère) mais l’intervalle de confiance dans cet article n’est pas mentionné (24). En 2013, Calcagnile et al confirment chez les patients en imprégnation éthylique ayant subi un TCMi et indemnes de lésions cérébrales, une majoration non significative (p=0.65) du taux de la protéine, en restant sous le seuil pathologique (25). Enochsson et al en 2005 obtiennent les mêmes résultats chez 19 patients, sous imprégnation et ayant subi un TMCi. Dans la seconde partie de leur étude, ils étudient le taux de la protéine chez des patients imprégnés sans traumatisme crânien (n=21) et confirment une majoration modérée du taux de protéine tout en restant sous le seuil pathologique de détection des lésions (26).
2. Le patient âgé
En 2013, Calcagnile et al (26), montrent qu’il existe une élévation significative du taux de P S100β chez les patients de plus de 65 ans (p value=0.029). Ceci suggère que chez ces patients âgés, il est difficile de faire l’impasse sur la tomographie cérébrale. Ce n’est donc pas dans cette population de patients qu’il faut chercher à diminuer le nombre de tomographies cérébrales. Notons, que sur le plan de la radioprotection, ces patients sont également moins ciblés que les populations de jeunes patients et/ou d’enfants.
3. Le patient sous anti-agrégant plaquettaire
En 2015, Thaler et al. (27), sur une cohorte de 782 patients ayant subi un traumatisme crânien, montrent de façon inattendue, qu’il n’existe pas de différence significative du taux d’hémorragie cérébrale entre les patients prenant ou pas des anti-agrégants plaquettaire respectivement 5,9% vs 8,6% (p value= 0.215). Dans la prise d’une telle médication, la protéine S100β semble rester un excellent paramètre de détection de lésions cérébrales. Le taux devient plus important lorsque l’on s’intéresse au patient de plus de 65 ans.
Chez les patients sous anti-agrégants, la P S100β semble garder sa valeur d’exclusion de lésions cérébrales avec une valeur prédictive négative de 99,6% et une sensibilité de 98% (IC : 89,5-99,7%). Néanmoins, le principe de précaution et le large IC suggèrent la poursuite de réalisation de tomographies en cas de doute clinique, au vu des tailles modestes des cohortes de patients et du peu d’études encore réalisées.
CONCLUSIONS
Le dosage de la P S100β combiné à l’examen clinique, semble avoir une bonne sensibilité pour guider le médecin urgentiste dans la prise en charge du traumatisme crânien mineur, et pour lui permettre d’identifier les patients à faible risque de complications chez qui la tomographie cérébrale peut être évitée. Il est d’autant plus efficace que le prélèvement est réalisé précocement dans les 3h ou 6h du traumatisme. Son utilité semble persister dans des situations particulières (les intoxications éthyliques où l’examen clinique est parfois peu fiable, les patients sous anti-agrégants…).
Néanmoins la sensibilité dans les études varie entre 72% et 100% avec un intervalle de confiance allant de 50% à 100%. Cette marge d’erreur potentielle (jusqu’à 50% selon l’étude) reste trop importante pour recommander à l’heure actuelle son implémentation dans nos services d’urgences, en comparaison avec d’autres biomarqueurs comme les D-dimères dans l’embolie pulmonaire où la marge d’erreur acceptée est de 3%.
Même si ce biomarqueur semble être très prometteur et que son utilisation est déjà proposée dans les pays scandinaves, on déplore néanmoins l’absence d’une large étude prospective multicentrique, dont les résultats permettraient de conforter la place de PS100β dans la démarche de prise en charge du traumatisme crânien mineur.
Recommandations pratiques
Le dosage de la P S100β dans la prise en charge du traumatisme crânien mineur semble très prometteur quant à l’identification de ces patients à faible risque de complications et permettrait ainsi d’optimaliser le recours au scanner cérébral. Sa sensibilité est d’autant plus élevée que le prélèvement sanguin se fait dans les 3 à 6h du traumatisme. Néanmoins, il manque encore à l’heure actuelle une étude prospective multicentrique pour conforter la place de P S100β dans la démarche de prise en charge du trauma crânien mineur.
AFFILIATIONS
1. Service des urgences, Clinique Saint-Jean, B-1000 Bruxelles
2. Service des urgences, Cliniques Universitaires Saint-Luc, B-1200 Bruxelles
3. Service des urgences, Hôpital Universitaire de Gand, B-9000 Gent
CORRESPONDANCE
Dr. Flore Tuyumbu
Clinique Saint-Jean
Service des urgences
Boulevard du Jardin Botanique 32
B-1000 Bruxelles
Tel : 02/221 94 42
floretuyumbu@hotmail.com
RÉFÉRENCES
- Di Somma S, Paladino L, Vaughan L, Lalle I, Magrini L, Magnanti M. Overcrowding in emergency department. An international issue. Intern Emerg Med. 2015; 10(2):171–175.
ouvrir dans Pubmed - Claessens YE, Mallet-Coste T, Riqué T, Macchi MA, Ray P, Chenevier-Gobeaux C. Biomarqueurs en médecine d’urgence : progrès et mésusage. Presse Med. 2014; 43:74–80.
ouvrir dans Pubmed - Larsson IM, Wallin E, Kristofferzon MJ, Niessner M, Zetterberg H, Rubertsson S. Post arrest serum levels of glial fibrillary acidic protein for predicting neurological outcome. Resuscitation. 2014;85(12):1654-1661.
ouvrir dans Pubmed - Nash LD, Bellolio F, Stead LG. S100 as acute marker of acute brain ischemia: a systematic review. Neurocrit Care. 2008;8:301-307.
ouvrir dans Pubmed - Renner NA, Redmann RK, Moroney-Rasmussen T, Sansing HA, Aye PP, Didier PJ et al. S100B as a novel and accessible indicator for the presence of monocyte- driven encephalitis in AIDS. Neuropathol Appl Neurobiol. 2012;38: 162-174.
ouvrir dans Pubmed - Routsi C, Stamataki E, Nanas Seraphim, Psachoulia C, Stathopoulos A, Koroneos A et al. Increased levels of serum S100B protein in critically ill patients without brain injury. Shock 2006;26:20-24.
ouvrir dans Pubmed - Hachimi-Idrissi S, Zizi M, Nguyen DC, Schiettecate J, Ebinger G, Michotte Y et al. The evolution of serum astroglial S-100B protein in patients with cardiac arrest treated with mild hypothermia. Resuscitation 2005;64(2):187-192.
ouvrir dans Pubmed - Ekmektzoglou KA, Xanthos T, Papadimitriou L. Biochemical markers (NSE,S-100,IL-8) as predictors of neurological outcome in patients after cardiac arrest and return of spontaneous circulation. Resuscitation 2007;75(2): 219-228.
ouvrir dans Pubmed - Raabe A, Kopetsch O, Groß U, Zimmermann M, Gebhart P. Measurements of Serum S-100B Protein: Effects of Storage Time and Temperature on Pre-Analytical Stability. Clin Chem Lab Med. 2003; 41(5):700–703.
ouvrir dans Pubmed - Ben Abdesselam O, Vally J, Adem C, Foglietti M-J, Beaudeux J-L. Reference values for serum S-100B protein depend on the race of individuals. Clin Chem Lab Med. 2003, 49, Issue 5.
ouvrir dans Pubmed - Peeters W, Van den Branden R, Polinder S, Brazinova A, Steyerberg EW, Lingsma HF et al. Epidemiology of traumatic brain injury in Europe. Acta Neurochir. 2015; 157(10):1683-1696.
ouvrir dans Pubmed - Stiell IG, Wells GA, Vandemheen K, Clement C, Lesiuk H, Laupacis A et al. The Canadians ct head rule for patients with minor head injury. Lancet. 2001;357:1391-1396.
ouvrir dans Pubmed - Haydel MJ, Preston CA, Mills TJ, Luber S, Blaudeau E, DeBlieux P. New Orleans ct rules, Indications for computed tomography in patients with minor head injury. N Engl J Med. 2000;343:100-105.
ouvrir dans Pubmed - Undèn J, Ingebrigsten T, Rommer B, Scandinavian Neurotrauma Committee. Scandinavian guidelines for initial management of minimal, mild and moderate head injuries in adults an evidence and consensus-based update. BMC Med. 2013;11:50.
ouvrir dans Pubmed - Undèn L, Calcagnile O, Undén J, Reinstrup P, Bazarian J. Validation of the Scandinavian guidelines for initial management of minimal, mild and moderate traumatic brain injury in adults. BMC Med. 2015;13:292.
ouvrir dans Pubmed - Ingebrigtsen T, Romner B, Kongstad P, Langbakk B. Increased serum concentrations of protein S-100 after minor head injury: a biochemical serum marker with prognostic value?. J Neurol, Neurosur Psychiatry. 1995;59:103-104.
ouvrir dans Pubmed - Biberthaler P, Linsenmeier U, Pfeifer KJ, Kroetz M, Mussack T, Kanz KG. Serum S-100B concentration provides additional information for the indication of computed tomography in patients after minor head injury: a prospective multicenter study. Shock. 2006;25: 446-453.
ouvrir dans Pubmed - Zongo D, Ribéreau-Gayon R, Masson F, Laborey M, Contrand B, Salmi LR et al. S-100B protein as a screening tool for the early assessment of minor head injury. Ann Emerg Med 2012; 59: 209-18.
ouvrir dans Pubmed - Calcagnile O, Undèn L, Undèn J. Clinical validation of S100B use in management of mild head injury. BMC Emerg Med 2012; 12-13.
ouvrir dans Pubmed - Laribi S, Kansao J, Borderie D, Collet C, Deschamps P, Ababsa R. S100B blood level measurement to exclude cerebral lesions after minor head injury: the multicenter STIC-S100 French study. Clin Chem Lab Med. 2014;52(4):527-536.
ouvrir dans Pubmed - San Miguel L, Benahmed N, Devos C, Roberfroid D. The role of biomarkers in ruling out cerebral lesions in mild cranial trauma. Health Technology Assessment (HTA): Belgian Health Care Knowledge Centre (KCE). KCE Reports 2016; D/2016/10.273/16.
- Ruan S, Noyes K, Bazarian J. The Economic Impact of S-100B as a Pre-Head CT Screening Test on Emergency Department Management of Adult Patients with Mild Traumatic Brain Injury. J. Neurotrauma. 2009;26:1655-1664.
ouvrir dans Pubmed - Biberthaler P, Mussack T, Wiedemann E, Gilg T, Soyka M, Koller G et al. Elevated serum levels of S-100B reflect the extent of brain injury in alcohol intoxicated patients after mild head trauma. Shock. 2001:97-101.
ouvrir dans Pubmed - Mussack T, Biberthaler P, Kanz KG, Heckl U, Gruber R, Linsenmaier U. Immediate S-100B and Neuron-specific enolase plasma measurements for rapid evaluation of primary brain damage in alcohol-intoxicated, minor head-injured patients. Shock. 2002;5: 395-400.
ouvrir dans Pubmed - Calcagnile O, Holmen A, Chew M, Undèn J. S100B levels are affected by older age but not by alcohol intoxication following mild traumatic brain injury. Scandinavian J. Trauma, resuscitation and emergency Medecine. 2013; 21-52.
ouvrir dans Pubmed - Enochsson L, Carlsson- Sanz S, Van der Linden J. The influence of alcohol and time on the S-100B levels of patients with minor head injury. Eur J Neurol. 2005;12: 445-448.
ouvrir dans Pubmed - Thaler H W, Schmidsfeld J, Pusch M, Pienaar S, Wunderer J, Pittermann P. Evaluation of S100B in the diagnosis of suspected intracranial hemorrhage after minor head injury in patients who are receiving platelet aggregation inhibitors and in patients 65 years of age and older. J Neurosurg. 2015;123(5):1202-1208.
ouvrir dans Pubmed - Romner B, Ingebrigtsen T, Kongstad P, Borgesen S. Traumatic brain damage: Serum S-100 protein measurements related to neuroradiological findings. J Neurotrauma.. 2000;17(8):641–647.
ouvrir dans Pubmed - Ingebrigtsen T, Romner B, Marup-Jensen S, Dons M, Lundqvist C, Bellner J, et al. The clinical value of serum S-100 protein measurements in minor head injury: a Scandinavian multicentre study. Brain Inj. 2000;14:1047–1055.
ouvrir dans Pubmed - Müller K, Townend W, Biasca N, Undén J, Waterloo K, Romner B, et al. S100B serum level predicts computed tomography findings after minor head injury. J Trauma. 2007;62:1452–1456.
ouvrir dans Pubmed - Morochovi R, Rácz O, Kitka M, Pingorová S, Cibur P, Tomková D, et al. Serum S100B protein in early management of patients after mild traumatic brain injury. Eur J Neurol. 2009;16(10):1112–1117.
ouvrir dans Pubmed - Muller B, Evangelopoulos DS, Bias K, Wildisen A, Zimmermann H, Exadaktylos AK. Can S-100B serum protein help to save cranial CT resources in a peripheral trauma centre? A study and consensus paper. Emerg Med J. 2011;28(11):938-940.
ouvrir dans Pubmed - Kotlyar S, Larkin GL, Moore CL, D’Onofrio G. S100b immunoassay: An assessment of diagnostic utility in minor head trauma. Emerg Med J. 2011;41(3):285-293.
ouvrir dans Pubmed - Egea-Guerrero JJ, Revuelto-Rey J, Murillo-Cabezas F, Munoz-Sanchez MA, Vilches-Arenas A, Sanchez-Linares P, et al. Accuracy of the S100beta protein as a marker of brain damage in traumatic brain injury. Brain Inj. 2012;26(1):76-82.
ouvrir dans Pubmed - Cervellin G, Benatti M, Carbucicchio A, Mattei L, Cerasti D, Aloe R, et al. Serum levels of protein S100B predict intracranial lesions in mild head injury. Clin Biochem. 2012;45(6):408-11.
ouvrir dans Pubmed - Metting Z, Wilczak N, Rodiger LA, Schaaf JM, Van Der Naalt J. GFAP and S100B in the acute phase of mild traumatic brain injury. Neurology. 2012;78(18):1428-1433.
ouvrir dans Pubmed - Wolf H, Frantal S, Pajenda GS, Salameh O, Widhalm H, Hajdu S, et al. Predictive value of neuromarkers supported by a set of clinical criteria in patients with mild traumatic brain injury: S100B protein and neuron-specific enolase on trial. J Neurosurg. 2013;118(6):1298-1303.
ouvrir dans Pubmed