La pathologie coronarienne chez l’enfant, une problématique fréquente en 2020
Jelena Hubrechts, Sylvie Lommaert, Stéphane Moniotte
Introduction
En 2020, le monde entier a été bouleversé par le virus SARS-CoV-2. En cardiologie pédiatrique, nous avons observé une recrudescence de patients présentant un tableau suggestif de maladie de Kawasaki, que ça soit sous sa forme typique, atypique ou encore la forme de « Kawasaki disease shock syndrome », un tableau caractérisé par une atteinte vasoplégique sévère. L’atteinte coronarienne inflammatoire avec le risque de développement d’anévrismes puis de sténoses multi-étagées reste une préoccupation majeure chez ces patients atteint de la maladie de Kawasaki.
De plus, une nouvelle entité clinique appelée syndrome MIS-C, acronyme de Multisystem Inflammatory Syndrome temporarily associated to COVID-19, initialement décrite comme le Paediatric Inflammatory Multisystem Syndrome Temporarily associated with Sars-CoV-2 (PIMS-TS). L’atteinte cardiaque chez des enfants avec un MIS-C est fréquente, notamment sous forme de dilatation coronarienne, épanchement péricardique, myocardite et dysfonction ventriculaire avec risque de choc vasoplégique chez un grand nombre de ces patients.
Clinique
Sur base des données épidémiologiques récentes, les jeunes enfants (0 à 5 ans) préalablement infectés par le SARS-CoV-2, présentent quelques semaines plus tard un syndrome similaire à la maladie de Kawasaki, tandis que les enfants plus âgés présentent principalement un MIS-C avec myocardite, défaillance ventriculaire gauche et état de choc. Des troubles gastro-intestinaux d’origine inflammatoire sont aussi fréquemment observés. Au niveau biologique, ces enfants présentent typiquement une thrombopénie et une lymphopénie associées à une augmentation des marqueurs inflammatoires que sont la C-Reactive Protein (CRP), les D-dimères, l’Interleukine-6, la Troponine I, et enfin le NT-proBNP.
Sur le plan cardiaque, sur bases de séries publiées en 2020, une dysfonction ventriculaire gauche sévère (<30% de fraction d’éjection) est observée dans 28% des cas, tandis qu’une altération modérée de la fonction inotrope (FE 30 à 50%) est présente dans plus de 70% des cas rapportés. La dilatation coronarienne a quant à elle une incidence de 17%-20% dans la maladie de Kawasaki, avec des anévrismes chez 15% des patients.
Prise en charge
Une grande proportion des patients avec MIS-C présentent aussi les critères diagnostiques de la maladie de Kawasaki.
Le traitement est donc assez similaire. Sur base d’une revue de la littérature, nous proposons pour les enfants avec la maladie de Kawasaki ou MIS-C sans choc, qu’ils bénéficient en première intention des immunoglobulines intraveineuses (IVIG, 2g/kg en une administration unique) et de l’aspirine à haute dose (80mg/kg en 4 doses par jour). Ce traitement sera initié sans délai, en vue de limiter l’atteinte inflammatoire des vaisseaux coronaires. En cas de résistance à une première dose d’IVIG, une seconde perfusion peut être proposée.
Non seulement le développement d’anévrismes coronaires géants, mais aussi l’occlusion thrombotique aigüe de ces lésions sont des complications sévères et potentiellement mortelles. Après une disparition de la fièvre et/ou normalisation de la CRP, la dose d’aspirine est diminuée à 3-5mg/kg en 1 prise par jour pendant au moins 6 semaines. Ce traitement est maintenu plus longtemps en cas de persistance d’une atteinte coronaire lors du suivi échographique et angiographique du patient. En cas d’anévrismes modérés (3-6mm), le clopidogrel (0.2-1.0 mg/kg 1x par jour) est fréquemment associé au traitement antiagrégant par aspirine.
En cas de risque accru de complications thromboemboliques, notamment chez les patients présentant une altération sévère de fonction ventriculaire (fraction d’éjection du VG < 30%) ou en cas de dilatation coronaire importante (Z-score >10) et précoce, une anticoagulation plus agressive doit être instaurée. L’héparine de bas poids moléculaire (HBPM) est alors administrée en 2 injections par jour, avec une posologie adaptée en fonction de l’âge du patient et du suivi de l’activité anti-Xa en vallée. L’anticoagulation par warfarine est souvent proposée en relais de l’HBPM après cette phase aigüe, sous réserve de contrôle strict de l’INR entre 2.0-3.0, ce qui s’avère difficile en pratique chez le petit enfant.
Les nouveaux anticoagulants par voie orale (NOAC) tel qu’un inhibiteur direct de la thrombine (dabigatran) ou les inhibiteurs du facteur Xa (apixaban, edoxaban et rivaroxaban) n’ont pas encore été étudiés à large échelle en pédiatrie.
La chirurgie de pontage coronaire reste également une option de dernier recours dans la population pédiatrique, bien que quelques cas aient été rapportés.
L’association de corticostéroïdes aux IVIG est proposée en phase aigüe si un ou plusieurs des éléments suivants sont présents : enfant de moins d’un an, Kawasaki avec choc vasoplégique, dilatation coronarienne objectivée au diagnostic (Z-score >2.5). La prednisolone est alors administrée par voie intraveineuse à 2mg/kg/jour en 3 doses pendant 5 jours ou jusqu’à disparition de la fièvre avec, ensuite, relais per os jusqu’à normalisation des paramètres biologiques d’inflammation et sevrage en 2 à 3 semaines habituellement. D’autres schémas sont décrits.
Dans des cas spécifiques, d’autres traitements immunomodulateurs peuvent également être proposés. En cas de choc, il va de soi qu’un traitement supportif avec fluides, support inotrope et agents vasopresseurs y est associé.
Perspectives
Un suivi régulier en cardiologie pédiatrique est indispensable pour ces patients. En effet, les anévrismes coronaires peuvent apparaître jusqu’à plusieurs mois voire années après les premiers symptômes de la maladie de Kawasaki. Ces anévrismes peuvent compromettre la vascularisation myocardique et induire une insuffisance coronaire tout au long de la vie des patients. Les mesures générales de prévention cardiovasculaire sont donc primordiales pour ces patients. Actuellement, le pronostic à moyen et long terme des enfants ayant développé une atteinte coronarienne lors de l’épidémie SARS-CoV-2 reste incertain. Seules les études cliniques futures pourront nous éclairer dans le futur. De plus, l’utilisation des NOAC en pédiatrie va certainement renforcer l’arsenal thérapeutique disponible pour ces patients et permettre d’améliorer la qualité de vie de nos patients sous anticoagulation au long cours.
Réferences
- Li Jiang, Kun Tang, Mike Levin, et al. COVID-19 and multisystem inflammatory syndrome in children and adolescents. Lancet Infect Dis. 2020; 20: e276–88.
- Whittaker E, Bamford A, Kenny J, et al. Clinical Characteristics of 58 Children With a Pediatric Inflammatory Multisystem Syndrome Temporally Associated With SARS-CoV-2. JAMA. 2020 Jul 21; 324(3):259-269.
- Riphagen S, Gomez X, Gonzalez-Martinez C, Wilkinson N, Theocharis P. Hyperinflammatory shock in children during COVID-19 pandemic. Lancet. 2020; 395(10237):1607-1608.
- Verdoni L, Mazza A, Gervasoni A, et al. An outbreak of severe Kawasaki-like disease at the Italian epicentre of the SARS-CoV-2 epidemic: an observational cohort study. Lancet. 2020; 395(10239):1771-1778.
- Lu X, Zhang L, Du H, et al. SARS-CoV-2 Infection in Children. N Engl J Med. 2020; 382(17):1663-1665.
- Belhadjer Z, Méot M, Bajolle F, Khraiche D, Legendre A, Abakka S et al. Acute Heart Failure in Multisystem Inflammatory Syndrome in Children in the Context of Global SARS-CoV-2 Pandemic. Circulation. 2020 Aug 4;142(5):429-436.
- Jarrett R. Linder, Lauren M. Andrade, Therese M. Giglia, Andrew C. Glatz. New options for anticoagulation in congenital and pediatric acquired heart disease. Progress in Pediatric Cardiology. 2020 ; 59 (01301):1058-9813.
Les inhibiteurs de l’enzyme de conversion de l’angiotensine remis en question dans la prévention de l’insuffisance cardiaque chez les enfants présentant un ventricule unique
Madeline Barbier, Laetitia Vanhoutte
Introduction
Les cardiopathies congénitales avec physiologie de ventricule unique (VU) sont un groupe hétérogène de pathologies qui fonctionnent avec une seule chambre cardiaque. Une correction n’étant pas possible, la prise en charge classique de ces patients implique plusieurs interventions de palliation chirurgicale permettant la séparation de la circulation pulmonaire et systémique (dérivation cavo-pulmonaire totale ou Fontan), améliorant ainsi leur survie à long terme. Cependant, la plupart de ces patients développe une insuffisance ventriculaire progressive qui constitue une cause de transplantation et de décès (1).
Chez les patients adultes qui ont un cœur anatomiquement normal, il a été démontré qu’une activation persistante du système rénine-angiotensine-aldostérone (SRAA) est néfaste dans la physiopathologie de l’insuffisance cardiaque (IC). Les inhibiteurs de l’enzyme de conversion (IEC) sont ainsi devenus un traitement incontournable de la décompensation cardiaque, diminuant la post charge du ventricule systémique et ralentissant le remodelage ventriculaire. Malgré l’absence d’évidence dans des études randomisées contrôlées, les IEC restent largement prescrits chez les patients avec VU. Pourtant, des données préliminaires ne valident pas cette approche (2,3).
Résultats
Une étude publiée en 2020 dans le Journal of American Heart Association remet en question l’utilité des IEC dans la prévention de l’IC chez des VU droits de type hypoplasie du ventricule gauche (4). Ces enfants bénéficient classiquement d’une première intervention de type Norwood en période néonatale, puis d’une procédure de dérivation cavo-pulmonaire partielle (DCPP) vers l’âge de 4 à 6 mois et enfin une dérivation cavo-pulmonaire totale (DCPT - ou Fontan) entre 2 et 4 ans.
L’étude rétrospective de cohorte de Hansen et al. a analysé les données de 2180 de ces patients enrôlés entre 2008 et 2016 dans 60 centres chirurgicaux suivant des cardiopathies congénitales en Amérique du Nord. Voici leurs conclusions :
- les IEC sont prescrits chez 38% des patients après la première étape de palliation, avec une diminution globale de prescription d’IEC pour la période 2011-2016 par rapport à la période avant 2010 (36.8% vs 45% ; p=0.005), et une grande variabilité entre les centres (range 7-100% ; p<0.001) avec une prescription moins importante dans les plus gros centres (P=0.004) ;
- les IEC sont plus souvent prescrits dans les pathologies de type canal atrio-ventriculaire mal balancé (OR, 1.85; 95% CI, 1.28–2.65) ou ventricule droit à double issue (OR, 1.47; 95% CI, 1.02–2.11), et si l’enfant a besoin d’une ventilation mécanique en préopératoire (OR, 1.37; 95% CI, 1.12–1.68) ou présente une fuite de la valve atrioventriculaire (AV) (OR, 1.88 ;95% CI, 1.22-2.31) ;
- les IEC ne diminuent ni la mortalité entre la première et la deuxième étape de palliation (P=0.662), ni la fuite de la valve AV (P=0.101), ni la dysfonction ventriculaire (P=0.134).
Perspectives
Cette étude remet en évidence les limites de l’extrapolation des données à des groupes de patients présentant des caractéristiques différentes (adulte vs. pédiatrique, anatomie normale vs. VU) et souligne l’absence de preuve de l’utilité des IEC dans les premières phases de palliation chirurgicale chez les patients avec VU droit. Ces données, additionnées aux quelques études préliminaires publiées sur le traitement de l’IC dans les VU, invitent le praticien à ne plus prescrire systématiquement des IEC chez ces patients, à moins d’une fuite importante de la valve AV ou d’une dysfonction ventriculaire avérée.
De manière générale, il semble important de poursuivre les investigations pour comprendre les mécanismes moléculaires de l’IC dans le contexte des cardiopathies congénitales et explorer de nouvelles pistes de traitement (5). Il faut aussi en analyser l’impact de manière différentielle dans les sous-groupes de cardiopathie.
Réferences
- Gewillig M. The Fontan Circulation. Heart. 2005;91:839-846.
- Hsu TD, Zak V, Mahony L, Sleeper LA, Atz AM, Levine JC, Barker PC, et al. Enalapril in Infants with Single Ventricle: Results of a Multicenter Randomized Trial. Circulation. 2010;122:333-340.
- Wilson TG, Iyengar AJ, d’Udekem Y. The Use and Misuse of ACE Inhibitors in Patients with Single Ventricle. Physiology. 2016;25:229-236.
- Hansen JE, Brown DW, Hanke SP, Bates KE, Tweddell JS, Hill G, Anderson JB. Angiotensin-Converting Enzyme Inhibitor Prescription for Patients with Single Ventricle Physiology Enrolled in the NPC-QIC Registry. J Am Heart Assoc. 2020;9:e014823.
- Garcia AM, Beatty J-T, Nakano SJ. Heart failure in single right ventricle congenital heart disease: physiological and molecular considerations. Am J Physiol Heart Circ Physiol. 2020;318:H947-H965.
Le cerclage de l’artère pulmonaire comme nouvelle stratégie de traitement dans la cardiomyopathie dilatée de l’enfant
Coralie De Bruyne, Mieke Roggen, Jelena Hubrechts
Introduction
La cardiomyopathie dilatée (CMD) reste une cause importante de mortalité chez l’enfant et l’incidence de récupération spontanée est faible (10-15%) (1). Malgré un traitement médicamenteux symptomatique qui se veut optimal, certains enfants développent une insuffisance cardiaque (IC) sévère avec nécessité d’assistance ventriculaire en attendant une transplantation cardiaque. Cette option est malheureusement peu réalisable en raison de la disponibilité et de la faisabilité dans la population pédiatrique.
En 2007, Schranz et al. (2) lancent pour la première fois l’idée du cerclage de l’artère pulmonaire (AP) pour traiter les CMD du ventricule gauche (VG) avec fonction du ventricule droit (VD) préservée, chez un nouveau-né de 2 mois sans chance réelle de pouvoir être greffé du cœur. Sur la décennie suivante, ils développent un protocole de traitement pour les nourrissons et jeunes enfants en IC sévère dans un contexte de CMD, avec une amélioration clinique attendue dans 80% des cas (1). En 2020, deux études indépendantes ont tenté de vérifier ces résultats et donnent des perspectives pour cette maladie grave.
Hypothèse thérapeutique
Le mécanisme d’amélioration de la fonction gauche suite au cerclage de l’AP dans les CMD s’expliquerait à différents niveaux. Tout d’abord, le cerclage de l’AP augmente la pression dans le VD et permettrait un shift du septum interventriculaire vers la gauche, amenant le VG dilaté en forme de « pomme » à une forme plus physiologique de « poire » (i.e. volume ventriculaire et insuffisance mitrale diminués) (Figure 1).
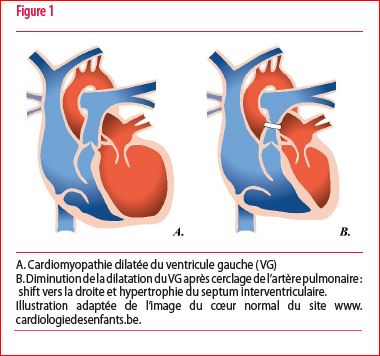
Il permet également d’augmenter la post-charge du VD et stimulerait ainsi sa contractilité. Une hypertrophie du VD et surtout du septum interventriculaire s’installe avec un potentiel endogène de récupération et de repopulation des myocardiocytes qui s’étendent vers le VG. La fonction ventriculaire controlatérale en bénéficierait. C’est l’hypothèse de la capacité régénératrice des myocardiocytes et le crosstalk ventriculaire.
De plus, le cerclage de l’AP induirait une diminution de la pré-charge gauche, avec des pressions de remplissage télédiastolique/télésystolique plus favorables pour la fraction d’éjection du VG (principe des courbes de Frank-Starling). En cas de récupération fonctionnelle cardiaque, avec la croissance, le cerclage peut progressivement être dilaté par ballon via cathétérisme cardiaque.
Résultats
Une première série (3) publiée en 2020 est une étude rétrospective, multicentrique (5 centres), réalisée aux USA, sans critères d’inclusion uniformes. Au total, 14 patients (âge médian de 5 mois) présentant une CMD avec dysfonction VG sévère (malgré traitement médicamenteux) mais fonction VD préservée, ont été inclus et ont bénéficié d’un cerclage de l’AP. Quatre patients ont présenté une fonction cardiaque améliorée ; 8 patients ont dû bénéficier d’une transplantation cardiaque ; et les deux derniers sont décédés.
La deuxième (4) série est une étude prospective, monocentrique ayant inclus 5 patients (âge médian de 8,6 mois) souffrant d’une CMD avec une fraction d’éjection de <30% et une fonction droite préservée. Trois patients ont récupéré une bonne fonction du VG ; un patient s’améliorant initialement s’est dégradé suite à une infection intercurrente et a dû être transplanté ; le dernier patient, sévèrement atteint à l’admission, n’a pas supporté l’intervention et a été mis sous assistance ventriculaire avant d’être transplanté avec succès. Aucun patient n’est donc décédé.
Perspectives
Ces deux dernières études ont des résultats prometteurs concernant la récupération de la fonction cardiaque dans les CMD avec IC sévère. Cependant, ce sont de petites cohortes, avec une durée de suivi limitée pour le moment. Nous ne pouvons donc pas encore affirmer que le cerclage de l’AP est l’unique facteur responsable de l’amélioration cardiaque (i.e. myocardite de résolution spontanée). Néanmoins, il s’agit d’une intervention techniquement relativement simple, sans nécessité de circulation extra-corporelle, qui permet de gagner du temps afin de pouvoir bénéficier d’une transplantation cardiaque.
Les références citées ont permis d’établir des critères d’inclusion et d’exclusion ainsi que des recommandations de la prise en charge per-opératoire de ces patients. Les Cliniques universitaires Saint-Luc, quant à elles, soutiennent et appliquent dès à présent cette stratégie de traitement pour la CMD pédiatrique. Dans le futur, il est nécessaire de réaliser d’autres études prospectives afin de mieux comprendre les mécanismes physiopathologiques en jeu et le rôle du cerclage de l’AP dans la prise en charge des IC sévères pédiatriques.
Références
- Schranz D, Recla S, Malcic I, Kerst G, Mini N, Akintuerk H. Pulmonary artery banding in dilative cardiomyopathy of young children: review and protocol based on the current knowledge. Transl Pediatr. 2019;8(2):151-60.
- Schranz D, Veldman A, Bartram U, Michel-Behnke I, Bauer J, Akintürk H. Pulmonary artery banding for idiopathic dilative cardiomyopathy: a novel therapeutic strategy using an old surgical procedure. J Thorac Cardiovasc Surg. 2007;134(3):796-7.
- Spigel ZA, Razzouk A, Nigro JJ, Karamlou TB, Kavarana MN, Roeser ME, et al. Pulmonary Artery Banding for Children With Dilated Cardiomyopathy: US Experience. Semin Thorac Cardiovasc Surg Pediatr Card Surg Annu. 2020;23:69-76.
- Di Candia A, Castaldi B, Bordin G, Cerutti A, Reffo E, Biffanti R, et al. Pulmonary Artery Banding for Ventricular Rehabilitation in Infants With Dilated Cardiomyopathy: Early Results in a Single-Center Experience. Front Pediatr. 2020;8:347.
La thérapie de resynchronisation cardiaque permet de diminuer le taux de transplantation cardiaque chez les patients pédiatriques et chez les patients atteints de cardiopathie congénitale
Christophe Vô
La thérapie de resynchronisation cardiaque (Cardiac Resynchronization Therapy (CRT)) connue également sous le nom de stimulation cardiaque biventriculaire, implique la stimulation simultanée des deux ventricules en vue d’instaurer une synchronisation ventriculaire. Elle est devenue un traitement établi chez les patients qui ont une insuffisance cardiaque à fraction d’éjection réduite associée à un asynchronisme électrique. Chez ces patients, la CRT a été associée à une amélioration significative de la mortalité et de la morbidité.
De précédentes études ont montré que la CRT peut améliorer les symptômes d’insuffisance cardiaque et la fraction d’éjection dans les populations pédiatriques et/ou atteintes de cardiopathie congénitale, mais l’évaluation de la survie sans transplantation n’a pas encore été étudiée.
L’équipe de cardiologie pédiatrique de l’Université de Stanford a publié, cette année, une étude extrêmement intéressante et prometteuse à propos de l’évaluation de la survie grâce à l’utilisation de la thérapie de resynchronisation cardiaque dans les populations pédiatriques et/ou atteintes de cardiopathie congénitale. Cette étude rétrospective est basée sur l’analyse d’appariement selon le score de propension (Propensity Score Matching (PSM)). Des patients ayant bénéficié d’une CRT ont été appariés à des contrôles selon 21 indices de comparaison. Les patients ayant bénéficié d’une CRT avaient, avant l’implantation de la CRT, moins de 21 ans ou avaient une cardiopathie congénitale, avaient une fraction d’éjection du ventricule systémique inférieure à 45%, une insuffisance cardiaque symptomatique et une asynchronie électrique significative. Les patients contrôles ont été inclus lorsqu’ils rencontraient les mêmes critères d’éligibilité que les patients CRT dans la même période d’étude (01/2004 – 12/2017). Après l’appariement selon le score de propension, 63 paires « patient CRT – patient contrôle » ont été identifiées, sans différence significative entre les groupes selon les indices de comparaison.
La transplantation cardiaque ou le décès a eu lieu dans 12 (19%) des patients CRT et 37 (59%) des patients contrôles avec un suivi médian de 2,7 ans (0,8-6,1 ans). L’utilisation de la CRT a donc réduit de manière importante le risque de transplantation cardiaque ou de décès.
L’analyse des sous-groupes révèle qu’aussi bien les patients atteints de cardiopathie congénitale que les patients suivis pour cardiomyopathie bénéficient de l’implantation d’une CRT. Chez les patients atteints de cardiopathie congénitale, il semble que les patients ayant un ventricule droit systémique bénéficie de manière significative de la CRT alors que les patients ayant une physiologie de ventricule unique n’atteignent pas le même bénéfice (mais seuls 9 patients avec un ventricule unique ont été inclus dans l’analyse). Il n’y a pas eu de mortalité procédurale liée à l’implantation de la CRT et une infection systémique a été rapportée après implantation de la CRT.
L’étude conclut que dans les populations pédiatriques et/ou porteuses d’une cardiopathie congénitale avec une insuffisance cardiaque systolique symptomatique et une asynchronie électrique significative, la CRT est associée à une augmentation significative de la survie sans transplantation.
Etant donné que le problème de l’insuffisance cardiaque symptomatique avec asynchronisme est très hétérogène dans les populations pédiatriques et/ou porteuses d’une cardiopathie congénitale, les études randomisées sont difficiles à mettre au point. L’analyse d’appariement selon le score de propension est un outil extrêmement utile pour évaluer cette problématique, même si, sur le plan épidémiologique, elle reste inférieure à l’étude contrôlée randomisée.
Sous réserve de ces considérations et en assumant que la méthodologie de l’étude est robuste, la CRT doit être considérée chez les patients pédiatriques et/ou porteurs d’une cardiopathie congénitale avec une insuffisance cardiaque systolique symptomatique et un QRS élargi à l’électrocardiogramme.
Références
Chubb H., Rosenthal DN, Almond CS, et al. Impact of Cardiac Resynchronization Therapy on Heart Transplant-Free Survival in Pediatric and Congenital Heart Disease Patients., Circ Arrhythm Electrophysiol. 2020.
L’importance de l’exercice chez les patients présentant une circulation de Fontan
Mieke Roggen, Jelena Hubrechts
Introduction
La circulation de Fontan, ou dérivation cavo-pulmonaire totale, a été développée comme stratégie palliative pour les patients avec un seul ventricule fonctionnel. L’avantage de ce type de circulation est que le sang 'bleu' est séparé du 'rouge' - le patient n’est plus cyanosé - et que le ventricule unique est débarrassé de la surcharge de volume. Le désavantage est que le retour veineux systémique est dépourvu de ventricule sous-pulmonaire et repose sur des forces non cardiaques pour fournir une précharge au ventricule systémique. En conséquence, de nombreux patients Fontan ont une capacité d’exercice réduite, ce qui est principalement liée à une réserve de précharge insuffisante. Historiquement, une prise en charge médicamenteuse était favorisée par rapport à la rééducation physique.
Physiopathologie
En 2020, plusieurs articles intéressants montrent l’importance de l’exercice physique dans cette population. Une circulation de Fontan efficace repose sur une faible résistance vasculaire pulmonaire. Mais, même avec un gradient transpulmonaire bas, la précharge est restreinte en raison de la vasculature pulmonaire qui constitue un barrage. Afin d’améliorer le retour veineux systémique vers les poumons, à la fois les muscles squelettiques périphériques et la pompe musculaire thoracique ont un rôle important. La pompe thoracique aspire le sang dans les poumons par une pression négative intrathoracique pendant l’inspiration et pousse le sang vers le cœur pendant l’expiration. La pompe musculaire périphérique, quant à elle, améliore le retour veineux systémique aussi bien au repos qu’à l’effort. Il a été démontré que la capacité d’exercice et le débit cardiaque systémique sont en corrélation avec la masse musculaire squelettique. Or, les patients Fontan sont prédisposés à une masse musculaire squelettique réduite, soit par diminution du flux sanguin, soit due à une cyanose chronique, soit encore par hypertension veineux systémique. Un autre élément défavorisant décrit dans ce groupe de patients concerne le taux d’adiposité plus élevé par rapport à un groupe de contrôle sans cardiopathie. Une nette corrélation existe avec le syndrome d’apnées du sommeil, le dysfonctionnement ventriculaire, la défaillance du circuit Fontan et une mortalité accrue.
Des études préliminaires suggèrent que le volume circulant s’améliore pendant l’exercice physique, ayant un effet bénéfique sur la privation chronique de précharge. Cela attribue à son tour au remodelage cardiaque. Finalement, l’exercice physique augmente le débit sanguin pulmonaire, permettant chez certains de ces patients de générer un flux pulsatile au niveau des artères pulmonaires. Des recherches futures seront nécessaires afin de montrer l’effet positif sur les résistances vasculaires pulmonaires.
Il est important de souligner que non seulement la capacité physique et la fonction cardiaque s’améliorent, mais surtout la qualité de vie. De plus, sous réserve d’un dépistage préalable approfondi, aucun événement indésirable n’est signalé.
Perspectives
L’Université d’Alberta (Canada) a développé et testé un module d’entraînement par intervalles à haute intensité. Le MedBIKE ™ est un ergomètre de télémédecine personnalisé, incorporant une plate-forme de jeu vidéo et une transmission directe de la vidéo / audio du patient, de l’électrocardiographie, de l’oxymétrie de pouls et de l’intensité de l’entrainement, vers une supervision médicale à distance. Après une période de test en trois phases, la conclusion est que le MedBIKE ™ a produit des réponses physiologiques similaires à celles d’un ergomètre de test d’effort cardio-pulmonaire. Le protocole d’entraînement par intervalles à haute intensité est sûr, faisable et agréable chez les jeunes avec une physiologie Fontan. Ce genre d’expériences est encourageant pour le futur de nos patients. La littérature scientifique étant convaincante, nous ne manquons de stimuler nos jeunes à faire du sport de manière régulière et efficace, d'autant plus durant cette période de confinement.
Références
- Baker D, Tran D, Cordina R. The Fontan Circulation: Is exercise training the solution? Progress in Pediatric Cardiology. 2020; 59.
- Scheffers L, vd Berg L, Ismailova G, Dulfer K, Takkenberg J, Helbing W. Physical exercise training in patients with a Fontan circulation : A systematic review. Prev Cardiol. 2020 Jul 27.
- Rato J, Sousa A, Cordeiro S, Mendes M, Anjos R. Sports practice predicts better functional capacity in children and adults with Fontan circulation. Int J Cardiol. 2020. May 1;306:67-72.
- Khoury M, Philips D, Wood P, Mott W, Stickland M, Boulanger P, et al. Cardiac rehabilitation in the pediatric Fontan population: development of a home-based high-intensity interval training programme. Cardiol Young. 2020 Oct;30(10):1409-1416.
Retour sur 25 ans de cardiologie pédiatrique
Stéphane Moniotte
Chaque année en Belgique, environ 1.000 enfants naissent porteurs d’une malformation cardiaque, et plus ou moins la moitié d’entre eux nécessitent un traitement. L’excellence dans la prise en charge et le traitement des malformations congénitales et acquises de l’enfant est le fruit d’une longue évolution de cette sous-spécialité médicale fascinante.
La cardiologie pédiatrique est en réalité une sous-spécialité très récente, apparue seulement dans la deuxième moitié du vingtième siècle. Avant l’amélioration des techniques chirurgicales et de la réanimation du nouveau-né, la grande majorité des patients nés avec une malformation cardiaque significative était malheureusement destinée à décéder dans les jours, les semaines ou les mois suivant la naissance.
Depuis 1936, date à laquelle le Dr Maude Abbott de Montréal a publié ses merveilleux atlas anatomiques sous les auspices de l’American Heart Association (1), la compréhension de l’embryologie et l’imagerie de l’anatomie des différentes malformations ont fait un formidable bon en avant.
Les années ‘50 sont celles des premières corrections chirurgicales à cœur ouvert aux Etats-Unis, suite à la mise au point et l’utilisation avec succès de la technique de la circulation extracorporelle (CEC) par le chirurgien Walton Lillehey et son équipe, en 1955 (Minneapolis).
Le 25 janvier 1958, la couverture de Paris-Match est dédiée à la première correction chirurgicale en France d’une malformation cardiaque chez un enfant, la petite Danielle, opérée d’une communication inter-auriculaire à l’âge de 7 ans. Les images tirées de ce magazine illustrent les moyens techniques utilisés à l’époque et permettent de se rendre compte des progrès réalisés depuis lors. La taille de la pompe de CEC est impressionnante et son fonctionnement requiert la présence de l’ingénieur qui l’a conçue. Treize donneurs de sang, dont 5 venus d’Outre-Atlantique vu la pénurie de donneurs, auront été nécessaires pour donner leur sang dans les 3 heures qui précèdent la chirurgie.
Depuis cette époque, des progrès remarquables ont transformé les malformations cardiaques dites incurables en affections reconnues et traitées en routine, conduisant le plus souvent à l’espérance d’une vie normale. Dès les années ‘50, les palliations et les traitements chirurgicaux de certaines malformations par chirurgie « à cœur fermé » ont été proposés. Il faudra attendre les années ‘60 pour que les chirurgies à cœur ouvert se généralisent, grâce au perfectionnement des techniques de circulation extra-corporelle. Dans les années ‘70, l’arrêt circulatoire et l’hypothermie profonde allaient ouvrir la voie nécessaire à la chirurgie réparatrice de la plupart des cardiopathies malformatives, y compris chez le jeune enfant.
L’éventail des possibilités de traitement s’est enfin enrichi, à la fin des années ‘80, des techniques du cathétérisme interventionnel. Celui-ci permet, grâce à l’introduction de divers cathéters dans le cœur via les vaisseaux sanguins, de fermer des communications anormales, d’élargir des communications indispensables, de dilater des vaisseaux et des valves, etc. La septostomie inter-auriculaire, qui permet d’élargir une communication entre les oreillettes, est réalisée en 1967 pour la première fois en Belgique à l’UCLouvain par le Professeur André Vliers, un an après la description de la technique par le Dr Rashkind aux Etats-Unis (2).
Dans cette revue des 20 dernières années de cardiologie pédiatrique clinique, nous proposons de revoir les progrès de cette spécialité qui ont permis l’amélioration constante de la prise en charge des patients.
Le diagnostic anténatal
La prise en charge des cardiopathies congénitales à révélation néonatale a été révolutionnée par la possibilité d’en faire le diagnostic in utero. Apparu au début des années 1970, le diagnostic anténatal par échocardiographie-Doppler, permet aujourd’hui un diagnostic précis dans la majorité des cas. L’amélioration de la qualité de l’imagerie obtenue ces 25 dernières années est le facteur principal responsable de ce progrès diagnostique.
En l’absence de diagnostic anténatal, le fœtus puis le nouveau-né atteint de cardiopathie grave suit un parcours semé d’embûches. La grossesse se poursuit en l’absence de diagnostic avec un risque de mort fœtale in utero. Après un accouchement dans une maternité générale, le diagnostic est suspecté plus ou moins rapidement en fonction de la gravité des symptômes et le nouveau-né est transféré dans un centre de référence en cardiologie pédiatrique, où le diagnostic est confirmé et précisé. Durant toute cette période, le risque de mortalité néonatale peut être élevé en fonction de la gravité de la cardiopathie.
La possibilité du diagnostic anténatal modifie ce parcours. D’une part, une interruption de grossesse peut être discutée si la cardiopathie est jugée non réparable. D’autre part, l’accouchement peut être programmé dans un centre spécialisé où la prise en charge médicale et chirurgicale peut être assurée dès la naissance. Un exemple typique pour lequel ces principes ont été démontrés est la transposition simple des gros vaisseaux, qui nécessite une prise en charge médico-chirurgicale précoce du patient. Il importe donc de poursuivre les efforts déjà entrepris pour augmenter le pourcentage de cardiopathies diagnostiquées en période prénatale et d’organiser la possibilité de transfert in utero et de prise en charge obstétricale et cardiologique dans un centre spécialisé.
Imagerie des cardiopathies congénitales
Alors que l’angiographie biplan avait permis le diagnostic anatomique et l’étude fonctionnelle de la majorité des cardiopathies dans les années ‘70 et ‘80, le développement de l’échocardiographie transthoracique en mode M, puis en 2D et Doppler couleur, a grandement facilité la description des critères morphologiques précis caractérisant le spectre complet des malformations cardiaques congénitales. Rapidement, l’échographie a remplacé le cathétérisme diagnostique comme outil diagnostic de première ligne, et les chirurgies cardiaques ont été planifiées uniquement sur base des résultats de l’échographie transthoracique réalisée au lit du malade.
Plus récemment, l’échographie cardiaque s’est encore affinée, avec l’apparition de l’échocardiographie 3D (tridimensionnelle), particulièrement utile dans l’évaluation des valvulopathies et des shunts intracardiaques, et de l’échographie transœsophagienne. Cette dernière est aujourd’hui réalisable même chez des enfants de très petit poids (2-3kg), permettant l’évaluation peropératoire des patients, et réduisant drastiquement le nombre de ré-interventions précoces.
Parmi les nouvelles modalités d’imagerie apparues au cours des 20 dernières années, citons également l’angioscan cardiaque et le coroscanner, l’IRM cardiaque, l’échocardiographie de stress, le Doppler tissulaire, le PET Scan et l’échographie intravasculaire. Ces techniques diagnostiques, utilisées seules ou combinées, nous permettent actuellement de préciser de façon très fine la morphologie cardiaque, la fonction systolique et diastolique biventriculaire, ainsi que la perfusion et la viabilité myocardique. Le développement de la résonance magnétique nucléaire est particulièrement récent et relevant en cardiologie pédiatrique, grâce à l’évaluation morphologique et combinée que permet la technique, malgré son caractère non-invasif et non irradiant. Cette approche permet également la création de modèles tridimensionnels utiles dans la planification de certaines interventions chez les patients porteurs de cardiopathies complexes. Comme évoqué plus haut, l’échocardiographie fœtale s’est elle aussi très fortement développée, et permet aujourd’hui d’offrir aux patientes des données diagnostiques, des conseils prénataux et une prise en charge de qualité.
Procédures percutanées et interventions hybrides
Au cours des 20 dernières années, le cathétérisme interventionnel est devenu le « traitement de choix » pour une série de pathologies cardiaques malformatives, comme la sténose valvulaire pulmonaire, et ce quel que soit l’âge du patient.
Depuis la description de la manœuvre de Rashkind (septostomie atriale au ballonet) en 1966, qui révolutionna le pronostic des patients avec transposition des grands vaisseaux, la sécurité et l’efficacité des procédures percutanées chez les nourrissons, les enfants et les adolescents a été confirmée par de très nombreuses publications. Les premières expériences publiées dans les années ‘60 concernaient essentiellement la fermeture percutanée de canaux artériels, mais rapidement, nous avons été témoins d’une véritable explosion des possibilités de traitement par cathétérisme, notamment suite à la fabrication d’une vaste gamme de cathéters, de ballons, de stents, de coils et de prothèses spécifiques à l’enfant.
Le cathétérisme interventionnel est aujourd’hui utilisé dans la prise en charge des patients avec sténose aortique, valvulaire ou supra-valvulaire; la coarctation de l’aorte, native ou postopératoire; les sténoses du lit vasculaire pulmonaire, acquises ou congénitales; ainsi qu’une grande variété d’obstructions « acquises », comme dans les chenaux de Mustard ou de Senning, après switch atrial pour transposition des grands vaisseaux.
La fermeture percutanée des canaux artériels est depuis longtemps devenue la technique de choix, y compris en période néonatale dans certaines équipes. La fermeture percutanée des communications inter-auriculaires (CIA) et du foramen ovale (PFO), ou des fenestrations de patients ayant bénéficié d’une opération de Fontan (anastomose cavo-pulmonaire totale) s’est également généralisée dans les années ‘90, grâce au développement de nouvelles générations de prothèses.
La fermeture des fistules coronaires, systémiques ou pulmonaires, et des communications inter-ventriculaires (CIV) musculaires s’est réalisée initialement dans les centres pionniers de Boston, Londres, Toronto et Houston. De nouvelles prothèses permettent aujourd’hui d’envisager la fermeture percutanée de certaines CIV périmembraneuses, malgré le risque de blocs auriculaires ou de lésions de la valve aortique, toute proche.
L’approche percutanée est aussi utilisée dans la dilatation de la voie d’éjection du ventricule droit dans la Tétralogie de Fallot, ainsi que dans la perforation par radiofréquence des valves pulmonaires chez les patients avec atrésie pulmonaire. Ces gestes s’accompagnent souvent de procédures plus complexes de réhabilitation de la vascularisation pulmonaire par l’introduction de stents endovasculaires dans les portions sténosées ou hypoplasiques du lit vasculaire pulmonaire. La disponibilité croissante de stents de tailles et de diamètres très variables a permis leur utilisation dans les coarctations de l’aorte ou les hypoplasies focales de l’arc aortique, dans les canaux artériels (pathologies ducto-dépendantes), dans le septum inter-auriculaire (pour faciliter le mixing sanguin dans les cardiopathies cyanogènes), dans certaines artérites inflammatoires (Takayasu), et dans de nombreux conduits chirurgicaux (conduits valvés VD-AP, shunts de Blalock, etc), le plus souvent de façon à différer la chirurgie de remplacement de quelques années.
Citons encore le remplacement valvulaire pulmonaire percutané, réalisé pour la première fois en Belgique en 2006, et rendu possible par le développement de la valve Melody par la firme Medtronic. Cette procédure offre de nombreux avantages : la procédure est sûre et ne dure qu’une à deux heures, le sternum ou le thorax ne doit plus être ouvert et il n’y a pas de nouvelle formation de brides autour du cœur. Le patient reste hospitalisé moins de 48 heures et ne ressent aucune douleur postopératoire, à l’exception d’un inconfort temporaire au niveau de l’aine. Aucune revalidation et aucun traitement médical post-procédure (anticoagulation par exemple) n’est nécessaire et on constate une amélioration rapide de la capacité physique du patient. Ces procédures sont actuellement réalisées en routine dans quatre centres de référence belges.
Enfin, il arrive que certaines procédures basées sur l’utilisation de cathéters et de ballons de dilatation soient réalisées lorsque le patient est ‘thorax ouvert’ en salle d’opération, de façon à limiter la durée de l’intervention, et à faciliter l’accès des zones anatomiques d’intérêt au médecin responsable du geste par cathétérisme. On parle alors de chirurgie hybride. Les applications typiques sont la fermeture de certaines CIV musculaires, la dilatation des artères pulmonaires périphériques inaccessibles au chirurgien lors d’une procédure en cours pour remplacement d’une homogreffe ou d’un conduit VD-AP, ou encore dans la prise en charge de cardiopathies complexes de type hypoplasie du ventricule gauche.
Les progrès chirurgicaux
La chirurgie des cardiopathies congénitales a présidé à la naissance de la chirurgie cardiaque, qu’il s’agisse de la chirurgie à cœur fermé (résection-anastomose de coarctation, shunt de Blalock) ou de la chirurgie à cœur ouvert (les premières interventions sous CEC ont concerné des patients atteints de cardiopathies congénitales). La chirurgie de l’adulte, valvulaire et coronarienne, a ensuite connu un essor extraordinaire et la chirurgie cardiaque pédiatrique est passée à l’arrière-plan. Il est vrai qu’elle représente moins de 10% de l’ensemble des actes de chirurgie cardiaque pratiqués dans un pays développé comme la Belgique.
La plupart des malformations cardiaques congénitales sont réparées dans la très petite enfance, de façon à procurer le plus tôt possible dans la vie une qualité de vie et de développement optimale.
La chirurgie cardiaque pédiatrique devient de plus en plus une chirurgie néonatale. Les enfants opérés de cardiopathie congénitale deviennent ensuite des adultes, chez lesquels des ré interventions sont souvent nécessaires. On estime que tout enfant dont la malformation cardiaque a été réparée nécessitera en moyenne 1,8 ré-interventions au cours de sa vie. Cette population est de plus en plus importante et va croître encore d’avantage dans les prochaines décennies (voir ci-dessous).
La chirurgie cardiaque n’est possible qu’entourée d’un environnement cardiologique, anesthésique et de soins intensifs pédiatriques spécifique. Les progrès réalisés dans ces domaines ont été considérables et on ne peut ici que les énumérer brièvement.
Comme évoqué ci-dessus, le domaine de la cardiologie pédiatrique a beaucoup évolué grâce au diagnostic précis permis par l’échocardiographie-Doppler, le développement des investigations par scanner ou IRM et l’essor considérable des techniques de cathétérisme interventionnel.
Dans le domaine de la CEC (Figure 8), nous retiendrons la miniaturisation des circuits de CEC, l’utilisation systématique de la normothermie (évitant les inconvénients hémorragiques et inflammatoires de l’hypothermie), la disparition de l’arrêt circulatoire hypothermique au profit de la perfusion cérébrale sélective, l’utilisation de l’ultrafiltration pour réduire les conséquences de la CEC sur l’équilibre hydro- électrolytique, l’emploi de produits anti- inflammatoires puissants (aprotinine), de techniques performantes de protection myocardique (cardioplégie sanguine chaude répétée) autorisant des réparations complexes avec clampage aortique prolongé.
Enfin, la réanimation post-opératoire s’est également transformée radicalement ces deux dernières décennies : technique de réanimation rapide avec extubation précoce, apparition de drogues inotropes puissantes à action sélective, traitement efficace des crises d’hypertension artérielle pulmonaire paroxystique (NO inhalé, sildénafil), possibilités d’assistance circulatoire prolongée par pompe centrifuge ou ventricule pneumatique para-corporel.
Prise en charge des cardiopathies congénitales à l’âge adulte
Le nombre de patients avec cardiopathie congénitale atteignant l’âge adulte (Grown-Up Congenital Heart disease (GUCH)) et se présentant en consultation de cardiologie est en constante augmentation. Ces patients sont soit porteurs d’une cardiopathie congénitale non diagnostiquée se révélant à l’âge adulte, soit présentent une cardiopathie connue, pour laquelle ils ont éventuellement bénéficié d’une ou de plusieurs interventions dans l’enfance.
Suite aux progrès du traitement des malformations cardiaques, on estime que la moitié des petits patients cardiaques ont actuellement dépassé l’âge de 18 ans. Ces adultes sont confrontés à un certain nombre de problèmes typiques de l’âge adulte et nécessitent un suivi médical adapté à la complexité de leur pathologie congénitale. Cette démarche nécessite la mise en commun de compétences complémentaires offertes par les services de Cardiologie, de Cardiologie Pédiatrique, de Chirurgie cardiovasculaire et de Médecine interne.
Au vu des progrès réalisés dans ce domaine et de la population grandissante de patients concernés, la prise en charge des patients ‘GUCH’ a fait l’objet de recommandations par la Société Européenne de Cardiologie, publiées en 2010 (3). Vu sa grande spécificité et la diversité des situations anatomo-cliniques rencontrées chez ces patients, un suivi en milieu spécialisé et la création de centres de référence sont clairement justifiés, en particulier chez les patients avec cardiopathie cyanogène.
Les progrès de la génétique
La cardiologie pédiatrique a été très influencée par les progrès réalisés ces dernières années dans le domaine de la génétique humaine. Les gènes codent pour un grand nombre d’anomalies cardiovasculaires qui atteignent les enfants. La description des syndromes cliniques associés à des cardiopathies est notamment très importante pour le diagnostic génétique et la prise en charge (multidisciplinaire) de ces enfants.
Parmi les pathologies pour lesquelles les progrès génétiques ont permis des avancées importantes, citons le syndrome du QT long, ou encore les syndromes de Marfan, de Williams, de Noonan, de Turner ou le syndrome de Down (Trisomie 21).
Le raffinement des techniques de caractérisation du génome a aussi permis de mieux comprendre des pathologies caractérisées par des mutations ou des microdélétions plus subtiles, telles que celles rencontrées dans le syndrome de microdélétions 22q11.
Les avancées considérables de la génétique moléculaire ont permis d’identifier de nombreux gènes responsables des cardiopathies congénitales. Le conseil génétique permet aujourd’hui d’intégrer ces connaissances génétiques en cardiologie clinique, et d’offrir d’avantage d’informations à tous les patients et leurs familles dans le cadre d’une consultation souvent pluri- disciplinaire entre les services de génétique médicale et de cardiopédiatrie. Les données plus précises obtenues par séquences encore plus précises du génome permettent d’améliorer les corrélations génotype-phénotype et d’établir à long terme des concepts thérapeutiques et préventifs adaptés spécifiquement à l’anomalie génétique de chaque patient. Les questions généralement posées par les familles peuvent le plus sou- vent être adressées sur base des connaissances accumulées au cours des 20 dernières années. Elles concernent l’hérédité des cardiopathies, les risques de récurrence et/ou de transmission, les risques liés aux autres membres de la famille, la disponibilité et la fiabilité des tests génétiques et les moyens de prévention. Ces questions sont spécifiques aux médecins généticiens qui y répondent aujourd’hui sous forme d’une consultation de conseil génétique. Etant donné qu’un diagnostic génétique a non seulement des conséquences pour l’individu atteint, mais également pour la famille entière, cette consultation de conseil génétique est désormais considérée comme une médecine de famille, une médecine du quotidien.
Et enfin une pandémie en 2021
Ces derniers mois, la spécialité a à nouveau été au cœur de l’actualité, avec l’apparition de cas inhabituellement fréquents de vasculaires et de myocardites survenues dans les 4-6 semaines suivant une infection par le Sars-CoV-2. Avec un tableau clinique proche de la maladie de Kawasaki, cette entité appelée MISC ou PIMS-TS (Multisystemic Inflammatory Syndrome in Children ou Pediatric Inflammatory Multisystem Syndrome Temporally associated with SARS-CoV-2 infection) affecte essentiellement les jeunes enfants. Il est intéressant de noter qu’une résurgence de cas similaires avec déjà été documentée en 2005, lors de l’apparition d’une autre souche de coronavirus (CoV-NH) (4).
La pathologie répond heureusement au traitement classique d’une vasculaire : immunoglobulines intraveineuses, traitement anti-inflammatoire puis antiagrégant par aspirine, et éventuellement corticothérapie dans les cas plus sévères, avec choc cardiotonique et altération profonde de la fonction ventriculaire gauche (5-6).
Bien que le développement de complications coronaires soient plutôt rares chez ces patients, les conséquences à plus long terme de ce syndrome sont encore inconnues. Le suivi au long cours de ces patients est donc très important.
Conclusions
La cardiologie pédiatrique et ses disciplines annexes (chirurgie, anesthésie, réanimation, génétique) ont connu une révolution spectaculaire et des avancées de taille au cours des 20 dernières années. Grâce à ces progrès, la toute grande majorité des cardiopathies congénitales peuvent être prises en charge de façon correctrice, et permettent d’offrir aux patients une vie de qualité. Il en résulte également une prise en charge optimisée de la population grandissante de patients adultes porteurs d’une cardiopathie congénitale, qui justifie la création de centres d’excellence spécialisés dans ce domaine.
Références
Abbott, M. (1936). Atlas of Congenital Cardiac Disease. New York. Rashkind WJ, Miller WW. Creation of an atrial septal defect without thoracotomy. A palliative approach to complete transposition of the great arteries. JAMA. 1966 Jun 13;196(11):991-992.
Baumgartner H, Bonhoeffer P, De Groot NM, de Haan F, Deanfield JE, Galie N, et al; Task Force on the Management of Grown-up Congenital Heart Disease of the European Society of Cardiology (ESC); Association for European Paediatric Cardiology (AEPC); ESC Committee for Practice Guidelines (CPG). ESC Guidelines for the management of grown-up congenital heart disease (new version 2010). Eur Heart J. 2010 Dec;31(23):2915-57.
Esper F, Shapiro ED, Weibel C, Ferguson D, Landry ML, Kahn JS. Association between a Novel Human Coronavirus and Kawasaki Disease. J Infect Dis. 2005 Feb 15; 191(4): 499-502.
Verdoni L, Mazza A, Gervasoni A, et al. An outbreak of severe Kawasaki-like disease at the Italian epicentre of the SARS-CoV-2 epidemic: an observational cohort study. Lancet. 2020;395(10239):1771-1778.
Viner RM, Whittaker E. Kawasaki-like disease: emerging complication during the COVID-19 pandemic. Lancet. 2020;395(10239):1741-1743.
Affiliations
Cliniques universitaires Saint-Luc, Service de cardiologie pédiatrique, B- 1200 Bruxelles, Belgique
Correspondance
Dr. Jelena Hubrechts
Cliniques universitaires Saint-Luc
Service de cardiologie pédiatrique
Avenue Hippocrate10
B-1200 Bruxelles
jelena.hubrechts@uclouvain.be