Introduction
La fibrose pulmonaire idiopathique (FPI) est la pneumopathie infiltrante diffuse (PID) la plus fréquente. Cette maladie chronique et létale provoque une fibrose interstitielle pulmonaire entrainant une insuffisance respiratoire et une mortalité accrue, avec une survie médiane rapportée de 2-4 ans (1). Plusieurs facteurs de risques sont décrits, tels que l’exposition au tabac et à des poussières de métal ou de bois. Le caractère familial de certain cas est reconnu depuis les années 1950 (2) et plus récemment, la prévalence des formes familiales de FPI a été estimée à 3.3-3.7% des cas (3). Ces formes familiales de fibrose se regroupent sous le dénominateur de fibrose pulmonaires familiale (FPF) et se définissent par la présence d’une PID chez au moins 2 membres apparentés au premier degré (4).
La compréhension des mécanismes génétiques impliqués dans ces maladies a permis de mettre à jour plusieurs polymorphismes prédisposant à leur développement. Le plus commun se situe au niveau du gène MUC5B et est présent chez 9% des personnes saines mais 38% des patients atteints de FPI (5). Hormis ces polymorphismes à pénétrance faible, plusieurs affections monogéniques, touchant principalement des gènes impliqués dans le surfactant et dans la biologie des télomères, peuvent causer le développement de PID chez les patients porteurs de mutations pathogènes.
Dans ce dernier groupe, les atteintes du complexe télomérase sont les formes les plus fréquentes et se caractérisent par une atteinte multi-systémique. Sous-diagnostiquées, elles impactent directement le pronostic vital des patients atteints et nécessitent un suivi particulier. Nous proposons d’illustrer ces pathologies par un cas clinique et par une revue de la littérature publiée concernant ces atteintes ainsi qu’une présentation de la structure mise en place aux Cliniques universitaires Saint-Luc (CUSL) afin de prendre en charge ces pathologies.
La biologie des télomères
Les télomères sont des structures génétiques non codantes, ayant un rôle protecteur au niveau des extrémités des chromosomes. Ces séquences d’acide désoxyribonucléique (ADN) se présentent sous forme de répétitions d’une séquence TTAGGG qui s’étendent sur des zones allant de 9 à 15 kilobases (6). En l’absence de processus compensatoire, la synthèse d’ADN via l’ADN polymérase lors de la réplication cellulaire entrainerait un raccourcissement des zones distales lié au problème de réplication terminal (figures 1 et 2B).
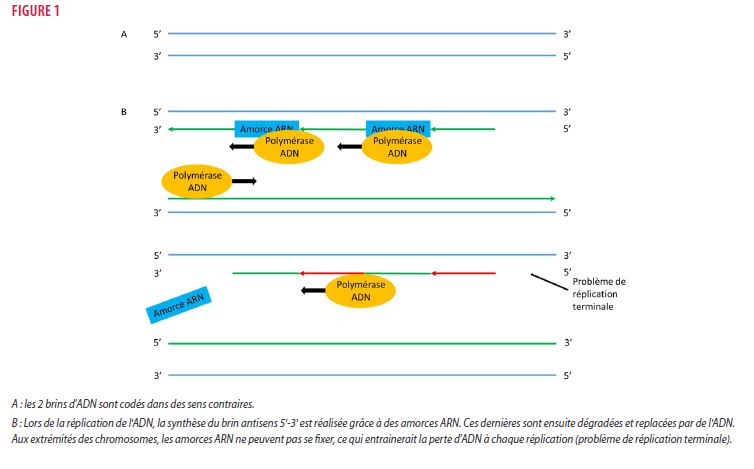
En effet, cette enzyme a besoin d’une extrémité 3’OH libre pour synthétiser la nouvelle molécule d’ADN, rendant la synthèse du brin uniquement possible dans le sens 5’-3’. L’ADN étant bidirectionnel et la réplication se faisant simultanément sur les 2 brins, la synthèse du brin indirect (c’est-à-dire du brin antisens 5’-3’ devant donc se réaliser dans le sens 3’-5’ et proposant une extrémité 5’OH libre) ne serait pas exécutable sans l’utilisation de fragments d’acide ribonucléique (ARN) servant d’amorce à la polymérase et permettant une synthèse dans le sens 5’-3’. Ces fragments sont ensuite dégradés et remplacés par de l’ADN via l’ADN polymérase. Aux extrémités des chromosomes, la réplication du dernier fragment pose problème car l’amorce ARN ne peut pas se fixer et le brin indirect serait donc amputé à chaque division, entraînant un raccourcissement progressif des télomères à chaque division (de l’ordre de 50-200 paires) et in fine un arrêt de la réplication. Afin de contourner ce problème, les cellules disposent d’une ribonucléoprotéine appelée « télomérase », qui, se servant de sa sous-unité ARN (Telomerase RNA Component ou TERC), va synthétiser les fragments d’ADN manquants via sa transcriptase inverse (Telomerase Reverse Transcriptase ou TERT) et ainsi permettre de maintenir la longueur des télomères (figure 2). La régulation de la longueur des télomères est un phénomène complexe dans lequel plusieurs protéines jouent un rôle protecteur et modulateur important, telles que la dyskerine (DKC1) (7), regulator of telomere elongation helicase 1 (RTEL1) (8), poly(A)-specific ribonuclease (PARN) (9) et le complexe shelterine, composé de 6 différents éléments (Telomere repeat Binding Factor (TRF1 et TRF2), repressor/activator protein 1(RAP1), TRF1- interacting nuclear protein 2(TIN2), TINT1/PTOP/PIP1 (TPP1) et protection of telomeres 1 (POT1).
Ce mécanisme n’est que peu actif dans les tissus somatiques à turn-over lent, limitant le nombre de réplications possibles (on parle de limite de Hayflick) et jouant un rôle dans le phénomène de vieillissement. Il est néanmoins fortement présent dans les tissus possédant une fréquence de division cellulaire élevée comme les cellules souches hématopoïétiques, permettant d’éviter un phénomène d’épuisement précoce.

Les pathologies liées aux télomères
Les mutations dans les gènes codant pour les protéines impliquées dans les mécanismes de régulation des télomères ont pour effet une perte de la fonction protectrice résultant en un arrêt de la réplication et une senescence ou une apoptose cellulaire suite à l’activation de mécanismes de réparation de l’ADN. Ces mutations germinales se transmettent sur un mode autosomique dominant dans 80% des cas (10). Une mutation héréditaire est retrouvée dans 40% des familles avec FPF, et lorsqu’une mutation est identifiée, il s’agira dans 75% des cas de mutations au sein des gènes impliqués dans la régulation des télomères (10). Les mutations touchent le plus souvent les gènes TERT (environ 15% des mutations répertoriées), RTEL1 (9%), TERC (5%) et PARN (4%) (10). Des mutations au niveau des gènes codant pour les protéines TINF2, NAF1 et DKC1 sont également décrites et représentent chacune environ 1% des diagnostics (10).
Les mutations germinales sont présentes dans toutes les cellules de l’organisme, rendant compte de la diversité des symptômes observées. Le développement de manifestations cliniques est dû à l’épuisement du potentiel réplicatif de certaines populations de cellules souches, plus particulièrement dans les tissus à turn-over cellulaire rapide, où les divisions cellulaires sont fréquentes et le raccourcissement télomérique donc accéléré. On observe néanmoins des atteintes dans des organes à réplication plus lente tel le poumon. Ce paradoxe s’explique par le fait que ces organes sont confrontés à un effet cumulatif de l’atteinte génétique, qui les prédispose au développement d’une pathologie, et à une exposition toxique environnementale (comme la fumée de cigarette ou certaines particules). Cette dernière entrainera une toxicité cellulaire ayant pour conséquence une augmentation des réplications, l’épuisement de certaines sous-populations de cellules et finalement l’apparition d’une atteinte clinique.
Les mutations germinales des gènes impliquées ont une pénétrance incomplète (certains individus porteurs de la mutation familiale ne développant pas la maladie), et une expressivité variable (atteinte de différents organes à des degrés variables d’un individu à l’autre). Ce phénomène s’explique par la diversité de l’exposition environnementale à laquelle ces apparentés sont confrontés. Par exemple, au sein d’une même famille, certains patients seront exposés au tabac et développeront une fibrose pulmonaire plus précoce, tandis que d’autres ne seront pas mis en contact et pourraient ne pas développer d’atteinte pulmonaire.
Enfin, la longueur des télomères se transmettant de façon verticale, on observe un phénomène d’anticipation au sein d’une même famille qui se traduit par une atteinte de plus en plus précoce au fil des générations du fait d’une diminution progressive de la longueur initiale des télomères (11). Cet héritage aura pour conséquence que dans une famille, même des apparentés non porteurs de la mutation familiale pourraient développer une atteinte au fil du temps du fait de leur réserve réplicative plus limitée (10, 12).
Présentation clinique
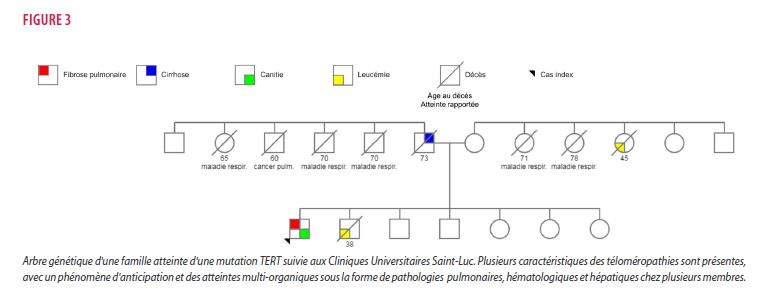
Un homme de 44 ans, non-fumeur, s’est présenté à la consultation de pneumologie avec des plaintes de dyspnée évolutive depuis 2 mois. Il ne présentait pas d’antécédents médicaux notoires avant l’apparition de ces symptômes. L’examen clinique a permis d’objectiver des crépitants bilatéraux diffus. Le bilan complémentaire a pu mettre en évidence une fibrose pulmonaire, avec des bronchiectasies de traction et des plages de verre dépoli diffus au scanner thoracique, incompatible avec un aspect de pneumopathie interstitielle commune. L’anamnèse systémique a permis de révéler une canitie (blanchiment des cheveux) précoce, de multiples atteintes pulmonaires non définies chez plusieurs membres de sa famille ainsi que le décès de son frère d’une leucémie myéloïde aiguë (figure 3). Au vu du contexte évocateur, une analyse génétique a été effectuée. Cette dernière a permis de mettre à jour une mutation faux-sens non documentée au niveau du gène TERT, considérée comme à haute probabilité de pathogénicité sur base de l’analyse informatique et du contexte clinique.
Comme illustré par ce cas, l’atteinte pulmonaire est la manifestation la plus fréquente de ces pathologies à l’âge adulte (13). On observe un effet cumulatif de l’âge et de l’exposition environnementale. Dans un groupe de patients porteurs de mutations dans le gène TERT, aucun cas de fibrose en dessous de 40 ans n’a été rapporté, alors que 50% des femmes et 60% des hommes mutés présentent une fibrose au-delà de 60 ans (14). Le type de gène muté semble également jouer un rôle dans la précocité du diagnostic, une étude récente rapportant un âge moyen plus jeune chez les patients porteurs de mutations dans le gène TERC que chez les patients porteurs de mutations PARN (TERC 51 ans, TERT 58 ans, RTEL1 60 ans, PARN 64 ans (15)). Ces valeurs sont à comparer avec l’âge moyen lors du diagnostic de la FPI en Belgique, qui est de 69 ans (16).
L’effet additif de l’environnement s’illustre par la fréquence importante d’exposition à un pneumotoxique (tabac, radiations, médicament..) dans 72-96% des patients (14, 17) et au tabac en particulier (40-63% des cas (14, 15, 17)).
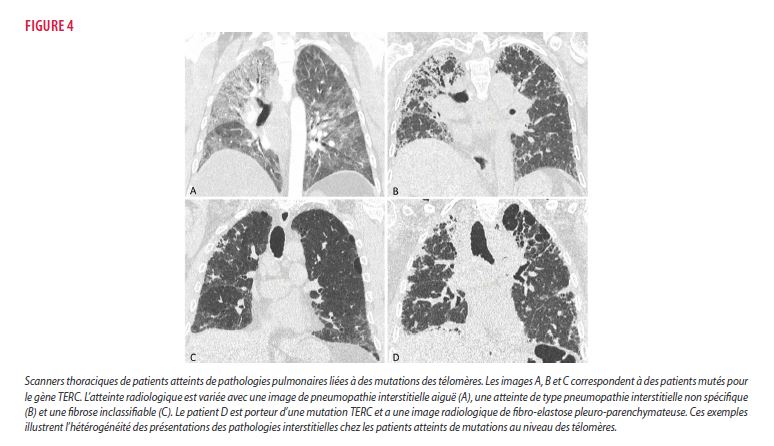
Cette atteinte pneumologique se caractérise par une fibrose pulmonaire hétérogène. Bien que l’image radiologique la plus fréquente soit celle d’une pneumonie interstitielle commune (PIC) qui est certaine dans 47-74% des cas (14, 15), 20% des patients se présentent avec des éléments incompatibles avec ce motif (14, 15). En corrélant les données anatomopathologiques et radiologiques, l’atteinte de type FPI, représentant 46-86% des diagnostics, est la manifestation la plus répandue des téloméropathies (14, 15, 17). On observe une hétérogénéité diagnostique chez les patients restants, avec des images rapportées de fibro-elastose pulmonaire (10%), de pneumonie interstitielle non spécifique (3-10%), de fibrose inclassifiable (17-20%), de pneumonie d’hypersensibilité (6-12%) ou de pneumonie desquamative (15, 17) (figure 4). Sur base des données actuelles, il n’existe donc pas de présentation pathognomonique radio-histologique permettant d’établir un diagnostic. De plus, il existe une mauvaise corrélation génotype-phénotype avec des atteintes variables chez des patients atteints d’une même mutation. Le diagnostic retenu n’a pas d’impact sur la survie des patients et ces derniers présentent un déclin respiratoire accéléré par rapport aux patients non mutés peu importe la pathologie respiratoire de présentation (15).
L’atteinte multi-organique est une des caractéristiques majeures des téloméropathies et touche principalement les systèmes hématologique, hépatique et cutané. Les atteintes hématologiques sont les secondes pathologies les plus prévalentes (15, 17). Elles se traduisent principalement sur le plan biologique par une thrombopénie, une anémie et/ou une macrocytose (15, 17). Ces patients présentent également un risque accru de développer des pathologies plus sévères comme les syndromes myélodysplasiques, les myélofibrose ou les leucémies myéloïdes aiguës (10). Au niveau hépatique, un risque accru de cirrhose hépatique secondaire ou cryptogénique ou d’hyperplasie nodulaire régénérative est également décrit (10). Enfin, les atteintes cutanées sont fréquentes chez les patients et se manifestent principalement sous la forme d’un blanchissement précoce des cheveux (canitie) avant 30 ans (17).
La présence d’une fibrose pulmonaire précoce associée à une histoire familiale de cirrhose ou d’hypertension portale non expliquée, et/ou la présence d’anomalies hématologiques doit faire évoquer la possibilité d’une téloméropathie sous-jacente. Une étude récente a démontré que chez les porteurs de mutations TERT/TERC, près de 80% présentaient des signes extra-pulmonaires (17). Les principaux prédicteurs de mutations des télomères chez ces patients sont le nombre d’apparentés présentant une fibrose pulmonaire idiopathique, la présence synchrone d’une thrombopénie, des anomalies cutanées et la présence d’atteintes hépatiques au sein de la famille (17).
Diagnostic
Une anamnèse familiale poussée, avec constitution d’un arbre généalogique, est cruciale et permet de mettre en évidence des atteintes pulmonaires, hépatiques ou hématologiques chez les apparentés et d’illustrer un phénomène d’anticipation.
Le bilan technique complémentaire sera similaire à celui d’une PID classique, consistant en un scanner thoracique de haute résolution, une échographie cardiaque, un lavage broncho-alvéolaire, une prise de sang et une fonction pulmonaire complète. L’intérêt de la biopsie pulmonaire chez ces patients en cas d’incertitude quant au diagnostic pneumologique est limité au vu de la progression uniforme indépendamment du type de PID développée (15). La prise en charge complémentaire se fera idéalement dans un centre tertiaire spécialisé en PID.
À ce jour, il n’existe pas de recommandation officielle concernant le dépistage des téloméropathies. En cas de contexte familial, d’atteinte précoce (<50 ans) et/ou d’atteinte multi-organique, une analyse génétique avec mesure de la longueur des télomères et dépistage des mutations connues pourra être demandée (10).
Les méthodes les plus fiables pour mesurer de la longueur des télomères sont l’analyse du segment de restriction terminal par Southern blot (18) et la cytométrie de flux couplée à la FISH (fluorescent in situ hybridisation) (flow- FISH) (19). Bien que la majorité des patients atteints de téloméropathie présentent des télomères courts, 10 à 20% présenteront une longueur de télomères conservée (supérieure au 10e percentile) au diagnostic (14, 15), justifiant un dépistage systématique des mutations pathogènes connues.
Le dépistage génétique doit s’effectuer au sein d’unités reconnues, habituées à ce type de diagnostic, permettant d’assurer des standards de qualité de prise en charge multidisciplinaires chez ces patients. Outre la prise en charge médicale, un accompagnement psychologique est systématiquement proposé.
L’intérêt du dépistage génétique chez les apparentés asymptomatiques (dépistage dit prédictif ou présymptomatique) est encore mal défini et sujet à discussion, surtout chez les mineurs. Il n’existe à ce jour pas d’étude démontrant un bénéfice chez ces patients. De plus, des anomalies interstitielles radiologiques sont fréquemment retrouvées dans cette population (20) sans que leur signification clinique soit claire à ce jour. Une mise au point génétique est possible mais doit être proposée au cas par cas sur avis d’expert et présentation au patient des éléments positifs et négatifs. Chez les porteurs asymptomatiques dépistés, un bilan initial complet de PID sera réalisé, avec un suivi annuel par une prise de sang et une fonction respiratoire, suivi d’un bilan CT-graphique en cas d'anomalie évolutive. Enfin, au vu de l’importance des facteurs environ-nementaux dans le développement d’une atteinte clinique, un arrêt de la consommation de tabac et un évitement des pneumotoxiques sont nécessaires dans les familles atteintes.
Traitements
La majorité des patients atteints de téloméropathies présentent une atteinte de type FPI et ont accès aux mêmes traitements anti-fibrosants que les patients touchés par la forme sporadique, tels le nintedanib et la pirfénidone. Ces deux médicaments ont démontré leur efficacité chez des patients atteint de FPI en diminuant d’environ 50% le déclin respiratoire (21, 22). À ce jour, il existe peu d’éléments permettant de juger de l’efficacité de ces traitements dans les téloméropathie, néanmoins, certaines données récentes suggèrent une absence d’effet de la pirfénidone (23). Il s’agit cependant de séries rétrospectives, dont les résultats doivent être interprétés avec prudence, dans l’attente d’études complémentaires.
Récemment, une étude prospective a démontré que l’administration d’un androgène de synthèse, le danazol, provoquait une élongation des télomères et ralentissait le déclin de la DLCO au prix d’effets secondaires fréquents (24). Au vu du dosage élevé utilisé, des évaluations complémentaires sont nécessaires afin de déterminer la dose et la place de ce traitement.
La seule thérapie curative de l’insuffisance respiratoire terminale liée à une atteinte interstitielle reste à ce jour la transplantation pulmonaire. Au vu de l’âge des patients au diagnostic, ceux-ci sont potentiellement candidats à cette procédure. A ce jour, même si une mortalité plus élevée chez les patients transplantés pulmonaires avec des télomères courts a été démontrée (25), les données disponibles chez les patients atteints de téloméropathies ne permettent pas de tirer de conclusions définitives (26, 27).
Sur base des séries publiées, les sujets porteurs de mutations semblent développer plus fréquemment des complications hématologiques en phase post-greffe, principalement sous la forme de thrombopénie et d’anémie (26, 27), nécessitant une adaptation du traitement immunosuppresseur. Une propension au développement d’insuffisances rénales a également été observée, avec des atteintes rénales aiguës et une fréquence d’épuration extra-rénale plus élevée directement en post-greffe (27) ainsi qu’une incidence augmentée d’insuffisances chroniques. Enfin, ces patients semblent à risque de développer des réactions médicamenteuses rares, avec par exemple plusieurs cas d’hépatite fulminante sur azathioprine rapportés (28).
Ces évènements adverses sont liés aux effets cytotoxiques des thérapies administrées dans le cadre de la greffe et aux mécanismes de compensation cellulaire insuffisants chez ces patients. Le développement de schémas médicamenteux spécifique plus légers est déjà utilisé chez les patients atteints de dyskératose congénitale(qui est une des formes les plus fréquentes de téloméropathie diagnostiquées chez l’enfant) et pourrait diminuer le taux de complications (29).
La prise en charge des téloméropathies aux Cliniques universitaires Saint-luc
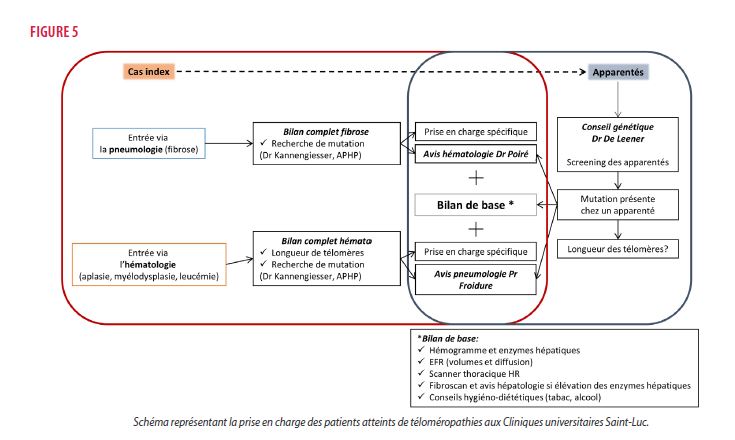
Depuis 2016, la prise en charge des PID au sein des Cliniques universitaires Saint-Luc (CUSL) est coordonnée par le Professeur Froidure. Conformément aux recommandations ATS/ERS (30), toutes les pathologies interstitielles sont discutées lors de réunion multidisciplinaire réunissant les services de pneumologie (Pr. A. Froidure, Pr. T. Pieters), le service de radiologie (Pr. B. Ghaye, Pr. E. Coche) et le service d’anatomopathologie (Dr. D. Hoton). En cas de suspicion de téloméropathies, un avis hématologique via le Dr. Poiré et une prise en charge génétique par le Dr. De Leener font partie du bilan de base. L’analyse génétique et la mesure de la longueur des télomères sont effectuées en collaboration avec l’hôpital Bichat à Paris (structure reprise au sein de la figure 5). La réalisation d’une analyse génétique chez les apparentés à risque est discutée avec le patient/la famille dans service de génétique des CUSL. En cas de mutation mise en évidence chez un apparenté asymptomatique, un bilan PID classique est alors réalisé dans un premier temps, avec un suivi annuel par prise de sang et fonction respiratoire.
Conclusion
Les téloméropathies forment un groupe d’affections monogéniques multisystémiques dont la manifestation la plus commune à l’âge adulte est une fibrose pulmonaire rapidement progressive. Le caractère systémique de la maladie, associé à la susceptibilité au développement de toxicités médicamenteuses nécessitent une prise en charge spécifique. Les Cliniques Universitaires Saint-Luc ont depuis 2016 mis en place un trajet de soin spécifique associant les services de pneumologie, hématologie et génétique. Dans les années à venir, une majoration du nombre de cas est à prévoir, du fait de la plus grande vigilance en première et seconde ligne par rapport aux fibroses pulmonaires, une évolution de la connaissance de ces pathologies et la subspécialisation de certains centres.
Bien que le pronostic de ces patients reste sombre, des traitements spécifiques aux téloméropathies et des schémas médicamenteux spécifiques devraient permettre de limiter les complications à l’avenir. Des études complémentaires sont nécessaires afin de s’assurer de l’efficacité des traitements anti-fibrosants, de valider des traitements immunosuppresseurs plus légers chez les patients greffés et de confirmer l’effet du danazol.
Recommandations pratiques
La présence d’une fibrose pulmonaire avant 50 ans, d’une atteinte multisystémique inexpliquée et/ou d’une composante familiale doit faire évoquer une fibrose pulmonaire familiale.
L’absence de mutation retrouvée n’exclut pas une fibrose pulmonaire familiale.
Une vigilance particulière est nécessaire lors de l’utilisation de traitements cytotoxiques au vu de la fréquence majorée d’effets secondaires.
Conflit d’intérêt
Les auteurs n’ont aucun conflit d’intérêts réel ou perçu, en relation avec cet article
Affiliations
1. Pôle de pneumologie, Institut de Recherche Expérimentale et Clinique, Université catholique de Louvain, Bruxelles
2. Service de pneumologie, Cliniques universitaires Saint-Luc, Bruxelles
3. Service d’hématologie, Cliniques universitaires Saint-Luc, Bruxelles
4. Centre de génétique humaine, Cliniques universitaires Saint-Luc, Bruxelles
Correspondance
Dr. Thomas Planté-Bordeneuve
Pôle de pneumologie, Institut de Recherche Expérimentale et Clinique
Tour Claude Bernard
Avenue Hippocrate 54
B-1200 Woluwe-Saint-Lambert
Belgique
Tel : 027649449
Références
- Richeldi L, Collard HR, Jones MG. Idiopathic pulmonary fibrosis. Lancet. 2017;389(10082):1941-52.
ouvrir dans Pubmed - Peabody JW, Peabody JW, Jr., Hayes EW, Hayes EW, Jr. Idiopathic pulmonary fibrosis; its occurrence in identical twin sisters. Dis Chest. 1950;18(4):330-44.
ouvrir dans Pubmed - Hodgson U, Laitinen T, Tukiainen P. Nationwide prevalence of sporadic and familial idiopathic pulmonary fibrosis: evidence of founder effect among multiplex families in Finland. Thorax. 2002;57(4):338-42.
ouvrir dans Pubmed - Talbert JL, Schwartz DA. Pulmonary Fibrosis, Familial. In: Adam MP, Ardinger HH, Pagon RA, Wallace SE, Bean LJH, Stephens K, et al., editors. GeneReviews((R)). Seattle (WA): University of Washington, Seattle. GeneReviews is a registered trademark of the University of Washington, Seattle. All rights reserved.; 1993.
- Seibold MA, Wise AL, Speer MC, Steele MP, Brown KK, Loyd JE, et al. A Common MUC5B Promoter Polymorphism and Pulmonary Fibrosis. N Engl J Med. 2011;364(16):1503-12.
ouvrir dans Pubmed - O’Sullivan RJ, Karlseder J. Telomeres: protecting chromosomes against genome instability. Nat Rev Mol Cell Biol. 2010;11(3):171-81.
ouvrir dans Pubmed - Cohen SB, Graham ME, Lovrecz GO, Bache N, Robinson PJ, Reddel RR. Protein Composition of Catalytically Active Human Telomerase from Immortal Cells. Science. 2007;315(5820):1850.
ouvrir dans Pubmed - Vannier J-B, Pavicic-Kaltenbrunner V, Petalcorin Mark IR, Ding H, Boulton Simon J. RTEL1 Dismantles T Loops and Counteracts Telomeric G4-DNA to Maintain Telomere Integrity. Cell. 2012;149(4):795-806.
ouvrir dans Pubmed - Moon DH, Segal M, Boyraz B, Guinan E, Hofmann I, Cahan P, et al. Poly(A)-specific ribonuclease (PARN) mediates 3'-end maturation of the telomerase RNA component. Nature genetics. 2015;47(12):1482-8.
ouvrir dans Pubmed - Borie R, Kannengiesser C, Sicre de Fontbrune F, Gouya L, Nathan N, Crestani B. Management of suspected monogenic lung fibrosis in a specialised centre. European Respiratory Review. 2017;26(144).
ouvrir dans Pubmed - Vulliamy T, Marrone A, Szydlo R, Walne A, Mason PJ, Dokal I. Disease anticipation is associated with progressive telomere shortening in families with dyskeratosis congenita due to mutations in TERC. Nat Genet. 2004;36(5):447-9.
ouvrir dans Pubmed - Alder JK, Cogan JD, Brown AF, Anderson CJ, Lawson WE, Lansdorp PM, et al. Ancestral Mutation in Telomerase Causes Defects in Repeat Addition Processivity and Manifests As Familial Pulmonary Fibrosis. PLOS Genetics. 2011;7(3):e1001352.
ouvrir dans Pubmed - Armanios M. Telomerase and idiopathic pulmonary fibrosis. Mutation research. 2012;730(1-2):52-8.
ouvrir dans Pubmed - Diaz de Leon A, Cronkhite JT, Katzenstein A-LA, Godwin JD, Raghu G, Glazer CS, et al. Telomere Lengths, Pulmonary Fibrosis and Telomerase (TERT) Mutations. PLOS ONE. 2010;5(5):e10680.
ouvrir dans Pubmed - Newton CA, Batra K, Torrealba J, Kozlitina J, Glazer CS, Aravena C, et al. Telomere-related lung fibrosis is diagnostically heterogeneous but uniformly progressive. Eur Respir J. 2016;48(6):1710-20.
ouvrir dans Pubmed - Wuyts W, Bondue B, Dahlqvist C, Slabbynck H, Schlesser M, Richir K, et al. PROOF: A Prospective Observational Registry to Describe the Disease Course and Outcomes of Idiopathic Pulmonary Fibrosis Patients in a Real-World Clinical Setting. PROOF-Registry Belgium - Luxembourg: Comorbidities in 175 IPF Patients at Inclusion. A103 IPF: MORE ABOUT THERAPY AND OUTCOMES. Am Thor Soc Int Conference Abstracts: American Thoracic Society; 2016. p. A2698-A.
- Borie R, Tabeze L, Thabut G, Nunes H, Cottin V, Marchand-Adam S, et al. Prevalence and characteristics of TERT and TERC mutations in suspected genetic pulmonary fibrosis. Eur Resp J. 2016;48(6):1721-31.
ouvrir dans Pubmed - Kimura M, Stone RC, Hunt SC, Skurnick J, Lu X, Cao X, et al. Measurement of telomere length by the Southern blot analysis of terminal restriction fragment lengths. Nature Protocols. 2010;5:1596.
ouvrir dans Pubmed - Baerlocher GM, Vulto I, de Jong G, Lansdorp PM. Flow cytometry and FISH to measure the average length of telomeres (flow FISH). Nature Protocols. 2006;1:2365.
ouvrir dans Pubmed - Kropski JA, Pritchett JM, Zoz DF, Crossno PF, Markin C, Garnett ET, et al. Extensive Phenotyping of Individuals at Risk for Familial Interstitial Pneumonia Reveals Clues to the Pathogenesis of Interstitial Lung Disease. Am J Resp Crit Care Med. 2014;191(4):417-26.
ouvrir dans Pubmed - King TE, Jr., Bradford WZ, Castro-Bernardini S, Fagan EA, Glaspole I, Glassberg MK, et al. A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis. N Engl J Med. 2014;370(22):2083-92.
ouvrir dans Pubmed - Richeldi L, du Bois RM, Raghu G, Azuma A, Brown KK, Costabel U, et al. Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis. N Engl J Med. 2014;370(22):2071-82.
ouvrir dans Pubmed - Justet A, Thabut G, Manali E, Molina Molina M, Kannengiesser C, Cadranel J, et al. Safety and efficacy of pirfenidone in patients carrying telomerase complex mutation. Eur Resp J. 2018.
- Townsley DM, Dumitriu B, Liu D, Biancotto A, Weinstein B, Chen C, et al. Danazol Treatment for Telomere Diseases. N Engl J Med. 2016;374(20):1922-31.
ouvrir dans Pubmed - Newton CA, Kozlitina J, Lines JR, Kaza V, Torres F, Garcia CK. Telomere length in patients with pulmonary fibrosis associated with chronic lung allograft dysfunction and post–lung transplantation survival. J Heart Lung Transplant. 2017;36(8):845-53.
ouvrir dans Pubmed - Borie R, Kannengiesser C, Hirschi S, Le Pavec J, Mal H, Bergot E, et al. Severe hematologic complications after lung transplantation in patients with telomerase complex mutations. J Heart Lung Transpl 2015;34(4):538-46.
ouvrir dans Pubmed - Silhan LL, Shah PD, Chambers DC, Snyder LD, Riise GC, Wagner CL, et al. Lung transplantation in telomerase mutation carriers with pulmonary fibrosis. Eur Resp J. 2014;44(1):178-87.
ouvrir dans Pubmed - Calado RT, Regal JA, Kleiner DE, Schrump DS, Peterson NR, Pons V, et al. A Spectrum of Severe Familial Liver Disorders Associate with Telomerase Mutations. PLOS ONE. 2009;4(11):e7926.
ouvrir dans Pubmed - Nelson AS, Marsh RA, Myers KC, Davies SM, Jodele S, O’Brien TA, et al. A Reduced-Intensity Conditioning Regimen for Patients with Dyskeratosis Congenita Undergoing Hematopoietic Stem Cell Transplantation. Biology of blood and marrow transplantation 2016;22(5):884-8.
ouvrir dans Pubmed - Raghu G, Remy-Jardin M, Myers JL, Richeldi L, Ryerson CJ, Lederer DJ, et al. Diagnosis of Idiopathic Pulmonary Fibrosis. An Official ATS/ERS/JRS/ALAT Clinical Practice Guideline. Am J Resp Crit Care Med. 2018;198(5):e44-e68.
ouvrir dans Pubmed