Impact de la pandémie de COVID-19 sur l’aérosolthérapie
Grégory Reychler, Nicolas Audag, Anne-Claire Latiers, Stéphanie Quennery
Cette pandémie a considérablement modifié le paysage de nombreux patients et ceux ayant besoin de nébulisations n’y ont pas échappé.
Rapidement, une transmission aéroportée a été suspectée en lien avec le SARS-CoV-2. Pour réduire le risque de transmission du virus, des recommandations visant à réduire voire proscrire la nébulisation de substances médicamenteuses au profit du recours aux aérosol-doseurs ont été établies dès le début de l’épidémie. Leur rationnel reposait sur le risque d’exposition des muqueuses et des yeux des soignants aux particules émises par le patient durant la séance de nébulisation ou par le nébuliseur en lui-même.
Les nébuliseurs de patients ont été depuis longtemps démontrés comme étant contaminés par différents germes, probablement par le patient et par son environnement mais aussi par l’entourage ou le personnel soignant. Dès lors, il a semblé logique d’imaginer que ce matériel puisse également être contaminé par le SARS-CoV2 et devenir vecteur de transmission. A ce jour, aucune donnée cependant n’a permis de vérifier cette hypothèse bien que cette dernière puisse être étayée par la stabilité observée du SARS-CoV2 sur le plastic pendant 3 jours (1). L’aérosol émis lors de la nébulisation pouvaient donc être chargé en virus et le transmettre par la dispersion démontrée des particules. Lors de l’épidémie de SARS-CoV1, l’aérosolisation de salbutamol avait d’ailleurs été associée à une contamination massive dans un hôpital de Hong Kong (2). Cette dispersion des particules est d’autant plus importante que la maladie est sévère au niveau respiratoire (3) ce qui renforçait son importance en milieu hospitalier. Comme la simple respiration d’une personne infectée suffit à la propagation de la COVID-19 le recours aux gestes barrière s’est imposé dès le début de l’épidémie. La toux qui peut être provoquée par la nébulisation devenait un facteur aggravant cette transmission. Le risque de contamination lié à cette modalité thérapeutique est accentué par à la stabilité démontrée du SARS-CoV2 dans un aérosol durant 3h (1). En se basant sur ce qui précède, aux cliniques et grâce à la rapidité d’action de la pharmacie, il a été décidé dès le mois de mars de remplacer les nébulisations classiques par des aérosol-doseurs pressurisés ou par la nébulisation moyennant un nébuliseur muni de filtre sur la branche expiratoire lorsque ceci n’était pas possible.
Références
- van Doremalen N, Bushmaker T, Morris DH, et al. Aerosol and surface stability of SARS-CoV-2 as compared with SARS-CoV-1. N Engl J Med. 2020; 382:1564-1567.
- Wong RS, Hui DS. Index patient and SARS outbreak in Hong Kong. Emerg Infect Dis. 2004;10:339-341.
- Hui DS, Chow BK, Chu LCY, et al. Exhaled air and aerosolized droplet dispersion during application of a jet nebulizer. Chest. 2009;135:648-654.
Effet collatéral de la pandémie de COVID-19 : coup de projecteur sur un outil artisanal décrit il y a 20 ans
William Poncin
Bien que l’oxygène soit utilisé à des fins médicales depuis plus de 100 ans (1) et qu’il figure sur la liste des médicaments essentiels de l’OMS depuis 1980 (2), son approvisionnement demeure inadéquat dans certaines régions du monde, en particulier dans les pays à revenu faible ou intermédiaire. En 2015, la Commission de la Chirurgie Mondiale du journal « The Lancet » rapporte que 24% des hôpitaux des pays à faible revenu manquent d’oxygène et que 70% des blocs opératoires subsahariens ne disposent pas d’oxymètres de pouls (3). Tout événement inattendu qui augmenterait fortement la demande en oxygène débordera mécaniquement le système lacunaire d’approvisionnement en oxygène de ces régions.
La catastrophe est donc inexorablement annoncée le 11 mars 2020, le jour où la propagation de la nouvelle maladie à coronavirus (COVID-19) est telle que l’OMS la qualifie de pandémie. La demande d’oxygène médical flambe pour subvenir au besoin des patients hypoxémiques affectés massivement. En Chine, en Europe et en Amérique du Nord, les hôpitaux ont réussi à faire face à l’ampleur inédite de la demande en oxygène, bien que l’apogée des pics infectieux ait mis à rude épreuve les systèmes modernes de (ré)approvisionnement de ce gaz (4). Les maisons de repos, moins bien pourvues en équipements médicaux, ont en revanche souffert de pénuries substantielles d’oxygène (5, 6), tout comme les pays à revenus faibles et intermédiaires (4). A titre d’exemple, les données des services hospitaliers du Malawi ont montré que 89% des patients hypoxémiques (SpO2 < 90%) ne recevaient pas d’oxygène (7).
Aux Cliniques universitaires Saint-Luc, en réponse à cette demande accrue, un système conçu il y a une vingtaine d’années a surgit des placards : le Double-Trunk Mask (DTM). Il s’agit simplement d’un masque d’aérosol auquel sont intégrés, dans les trous latéraux, deux tubulures annelées de 15 cm de long et de 22 mm de diamètre (8). En positionnant ce montage au-dessus du moyen d’administration classique d’oxygène du patient, les canules nasales, l’oxygène non consommé par le patient (à cause des phases expiratoires, d’une respiration buccale ou d’une respiration superficielle) est séquestré dans le système avant d’être restitué au patient à chaque inspiration. C’est pourquoi le DTM agit comme un véritable « booster » d’oxygène : pour un débit inchangé en oxygène, l’ajout du DTM augmente la PaO2 (8, 9).
Dans le même ordre d’idées, le DTM peut être utilisé pour réduire le débit d’oxygène tout en conservant un objectif de SpO2 donné. Une publication récente a effectivement montré que le DTM permettait d’économiser 50% d’oxygène en moyenne chez le patient COVID-19 hospitalisé dans les unités des soins hors soins intensifs (10). Il s’agit donc d’une économie substantielle qui pourrait s’avérer cruciale dans toute situation où les gaz médicaux sont une denrée rare. D’autres avantages pragmatiques sont associés à cet outil : il n’est pas breveté et se construit aisément à l’aide de consommables bons marchés et largement accessibles dans de nombreux établissements de soin.
Cette crise sanitaire sans précédent aura mis en évidence la fragilité des systèmes d’approvisionnement en oxygène dans différents pays, tous revenus confondus, y compris la Belgique (11). Elle nous oblige à requestionner la manière dont nous abordons cette thérapie essentielle, tenue pour acquise en Europe. C’est l’effet collatéral positif de la pandémie. Elle aura au moins contribué à mettre sous les projecteurs un simple dispositif d’oxygénation déjà accessible en presque tout lieu et qui était quasi inconnu jusqu’alors.
Références
- Duke T, Graham SM, Cherian MN, Ginsburg AS, English M, Howie S, et al. Oxygen is an essential medicine: a call for international action. Int J Tuberc Lung Dis. 2010; 14: 1362-1368.
- The WHO Expert Committee on Selection and Use of Essential Medicines. The Selection and Use of Essential Medicines - TRS - 641. 1980. Available from: https://www.who.int/groups/expert-committee-on-selection-and-use-of-esse....
- Meara JG, Leather AJ, Hagander L, Alkire BC, Alonso N, Ameh EA, et al. Global Surgery 2030: evidence and solutions for achieving health, welfare, and economic development. Lancet. 2015; 386: 569-624.
- Smith L, Baker T, Demombynes G, Yadav P. COVID-19 and Oxygen: Selecting Supply Options in LMICs that Balance Immediate Needs with Long-Term Cost-Effectiveness. Center for Global Development. 2020. Available from: https://www.cgdev.org/publication/covid-19-and-oxygen-selecting-supply-o....
- Trabucchi M, De Leo D. Nursing homes or besieged castles: COVID-19 in northern Italy. Lancet Psychiatry. 2020; 7: 387-388.
- Dendooven L. Manque d’oxygène: maisons de repos et urgences en état d’asphyxie, un nouveau masque à la rescousse. Radio-télévision belge de la Communauté française (RTBF); 2020.
- Baker T, Schell CO, Petersen DB, Sawe H, Khalid K, Mndolo S, et al. Essential care of critical illness must not be forgotten in the COVID-19 pandemic. Lancet. 2020; 395: 1253-1254.
- Duprez F, Bruyneel A, Machayekhi S, Droguet M, Bouckaert Y, Brimioulle S, et al. The Double-Trunk Mask Improves Oxygenation During High-Flow Nasal Cannula Therapy for Acute Hypoxemic Respiratory Failure. Respir Care. 2019; 64: 908-914.
- Duprez F, Cocu S, Legrand A, Brimioulle S, Mashayekhi S, Bodur G, et al. Improvement of arterial oxygenation using the double trunk mask above low flow nasal cannula: a pilot study. J Clin Monit Comput. 2020.
- Poncin W, Baudet L, Reychler G, Duprez F, Liistro G, Belkhir L, et al. Impact of an Improvised System on Preserving Oxygen Supplies in Patients With COVID-19. Arch Bronconeumol. 2020.
- Coronavirus : mesures prises par l’AFMPS et les partenaires concernés pour continuer à garantir l’approvisionnement en oxygène. Available from: https://www.afmps.be/fr/news/coronavirus_mesures_prises_par_lafmps_et_le....
SARS-CoV-2 et SAOS : effet protecteur de la CPAP chez les patients SAOS ayant une bonne compliance
Gimbada Mwenge, Giuseppe Liistro, Charlotte Smetcoren
Les patients ayant une atteinte respiratoire sévère liée au SARS-CoV-2 partagent des facteurs de risques communs avec ceux atteints de syndrome d’apnée obstructive du sommeil (SAOS) (Obésité, maladies cardiovasculaires, hypertension, diabète, âge et sexe masculin). Des preuves associant le SAOS et la gravité de l’atteinte par Le COVID 19 sont apportées dans des études récentes (1,2). Celles-ci révèlent que le SAOS serait un facteur prédisposant indépendant de mortalité à 7 jours et d’atteinte sévère (admission en soins intensifs, de ventilation mécanique et d’hospitalisation) (OR :1,79-OR 2.65 respectivement). À âge comparable, les patients atteints de SAOS seraient 8 fois plus à risque d’avoir une atteinte sévère (3). En effet, en raison de l’hypoxie intermittente et de la privation de sommeil, le SAOS non traité serait responsable de la production de cytokines inflammatoires telles que l’interleukine-6 et -17 et TNF alpha (4). De plus, la dysrégulation de l’axe rénine-angiotensine-aldostérone retrouvée dans le SAOS constitue un lien potentiel supplémentaire dans la pénétration du virus via les récepteurs de l’enzyme de conversion de l’angiotensine (ECA)-2(5). Cependant, au début de l’épidémie de COVID 19, certains auteurs ont suggéré que les patients traités par CPAP devraient interrompre leur traitement en raison du risque d’aérosolisation du virus (6). En effet, les fuites intentionnelles du masque et les débits d’air élevés délivrés par l’appareil pourraient contribuer à la propagation du virus dans l’environnement du patient et donc à l’exposition de son entourage (6). Cependant, nous avons constaté que le traitement par CPAP ou par ventilation non invasive, souvent associé à l’oxygénothérapie, s’est avéré efficace lorsque les critères d’intubation endo-trachéale n’étaient pas encore réunis (7). Par ailleurs, il a été démontré que le traitement par CPAP réduit la morbi -mortalité liée au SAOS chez les patients ayant une bonne observance à ce traitement.
Nous souhaitons faire part de nos observations chez deux patients atteints de SAOS sévère (AHI 78.1/h et 55 /h) et d’hypertension artérielle traitée, âgés de 40 et 45 ans. Ces patients se sont présentés en salle d’urgence avec des signes cliniques modérés, l’absence d’hypoxémie à l’air ambiant et sont donc retournés au domicile. La PCR s’est révélée positive au SARS-CoV-2.
Néanmoins, chez les deux patients, l’imagerie thoracique a montré des images de verre dépoli, de sorte qu’un diagnostic de pneumonie COVID19 devait être retenu chez eux. Les patients avaient tous deux présenté de la fièvre et ils avaient poursuivi leur traitement de CPAP à domicile pendant l’infection par COVID 19 avec une compliance moyenne de plus de 6 heures/nuit. Un des patients a signalé une dyspnée majeure, qui a été soulagée par l’utilisation de la CPAP. Ces observations nous mènent à penser qu’il serait utile de suggérer la poursuite du traitement par CPAP chez les patients souffrant d’apnée obstructive du sommeil pendant une infection par le SRAS-CoV-2. Notons également que chez des patients hospitalisés, ayant bénéficié d’un traitement par CPAP avec une adaptation de la fuite intentionnelle, ainsi que l’ajout d’un filtre HEPA, aucune propagation de virus n’a été signalée (8). En outre, la CPAP pourrait soulager la dyspnée, et diminuer le risque d’une évolution péjorative chez ces patients à risque d’insuffisance respiratoire sévère et de décès.
Nous pensons que, malgré leur vulnérabilité, les patients atteints de SAOS traités pourraient être protégés par la pression positive générée par la CPAP, en maintenant leurs espaces alvéolaires ouverts et en favorisant un meilleur échange gazeux. D’autant plus, la CPAP s’est avérée efficace dans le traitement de l’insuffisance respiratoire dans le cas de COVID19 lorsqu’elle est combinée à l’oxygénothérapie. Nous pensons donc que des recommandations devraient être faites pour s’assurer que les patients atteints du syndrome d’apnée du sommeil puissent poursuivre leur traitement, tout en prévoyant des mesures efficaces pour protéger leur entourage.
Références
- Cade BE, Dashti HS, Hassan SM, Redline S, Karlson EW. Sleep Apnea and COVID-19 Mortality and Hospitalization.. Am J Respir Crit Care Med. 2020 ; 202(10): 1462–1464.µ
- Bertrand Carious, CORONADO investigators. Phenotypic characteristics and prognosis of inpatients with COVID-19 and diabetes: the CORONADO study Diabetologia. 2020; 63(8): 1500–1515.
- Maas MB, Kim M, Malkani RG, Abbott SM, Zee PC. Obstructive Sleep Apnea and Risk of COVID-19 Infection, Hospitalization and Respiratory Failure. Sleep Breath. 2020; S29;1-3.
- Salles C, Mascarenhas Barbosa H. COVID-19 and obstructive sleep apnea. J Clin Sleep Med. 2020;16(9):1647.
- Ekiz T, İnönü Köseoğlu H, Pazarlı AC.Ekiz T, et al Obstructive sleep apnea, renin-angiotensin system, and COVID-19: possible interactions. . J Clin Sleep Med. 2020 Aug 15;16(8):1403-1404. doi: 10.5664/jcsm.8576.
- Barker J, Oyefeso O, Koeckerling D, Mudalige NL, Pan D. COVID-19: community CPAP and NIV should be stopped unless medically necessary to support life. Thorax. 2020;75(5):367.
- Pfeifer M, Ewig S, Voshaar T, Randerath W, Bauer T, Geiseler J, et al. Position Paper for the State-of-the-Art Application of Respiratory Support in Patients with COVID-19 - German Respiratory Society. Pneumologie. 2020 ;74(6):337-357.
- Stawicki SP, Jeanmonod R, Miller AC, Paladino L, Gaieski DF, Yaffee AQ, et al. The 2019–2020 Novel Coronavirus (Severe Acute Respiratory Syndrome Coronavirus 2) Pandemic: A Joint American College of Academic International Medicine-World Academic Council of Emergency Medicine Multidisciplinary COVID-19 Working Group Consensus Paper. J Glob Infect Dis. 2020 ;12(2): 47–93.
- Oranger M, Gonzalez-Bermejo J, Dacosta-Noble P, Llontop C, Guerder A, Trosini-Desert V, et al. Continuous positive airway pressure to avoid intubation in SARS-CoV-2 pneumonia: a two-period retrospective case-control study Eur Respir. J. 56(2).
Le cancer du poumon : un modèle de médecine personnalisée en oncologie clinique
Frank Aboubakar
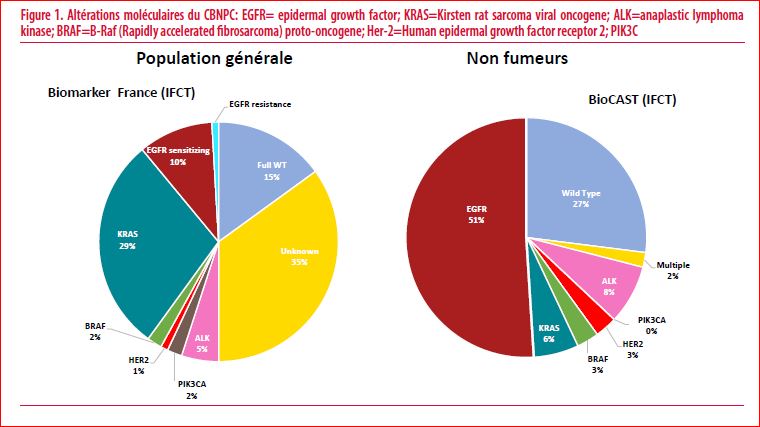
Le cancer du poumon est le cancer le plus fréquent et la première cause de mortalité par cancer dans le monde avec respectivement 2,093 millions de nouveaux diagnostics et 1,7 million de décès chaque année (1). Jusqu’aux années 2004, le cancer du poumon était subdivisé en deux entités selon l’aspect des cellules tumorales au microscope (i.e. l’histologie) (2) : le cancer bronchique non à petites cellules (CBNPC) et le cancer bronchique à petites cellules (CBPC) représentant respectivement 85% et 15% des cancers du poumon (3). Le changement de paradigme et les avancées thérapeutiques dans la prise en charge du cancer du poumon est concomitante au développement et à la démocratisation des techniques de biologie moléculaire en l’occurrence les techniques de séquençage de haut débit des acides nucléiques (next generation sequencing, NGS). L’identification en 2004 des mutations activatrices du gène de l’epidermal growth factor receptor (EGFR) dans le cancer du poumon signe le passage de l’ère « histologique » à l’ère « moléculaire » du CBNPC (2). La classification moléculaire du CBNPC va s’amplifier avec l’dentification du réarrangement du gène anaplastic lymphoma kinase (ALK) en 2007, la fusion du gène c-ros oncogène 1 (ROS1) et ret proto-oncogene (RET) en 2012 (Figure 1). Plus récemment, l’identification de la mutation du gène B-Raf proto-oncogène (BRAF V600E) localisée sur le codon 600 et aboutit à la substitution de l’acide aminé valine (V) en acide aminé glutamate (E), l’amplification du gène EGFR-2 (HER-2) connue dans le cancer du sein, l’amplification et la mutation de l’exon 14 du gène MET et enfin la fusion du gène neurotrophic tyrosine receptor kinase (NTRK) sont venu compléter la classification moléculaire des CBNPC.
 =
=
Toutes ces anomalies génétiques sont acquises par les cellules épithéliales bronchiques et donnent par conséquent un avantage prolifératif qui sont à l’origine de ce type de cancer du poumon. Ces anomalies moléculaires ne sont donc pas transmissibles à la descendance car elles ont spécifiques des cellules cancéreuses. L’autre point commun de ces anomalies génétiques est que chacune d’elles code pour une protéine kinase constitutivement active qui est à l’origine du signal de prolifération excessif de la cellule cancéreuse. Ces anomalies moléculaires sont exclusives, la présence d’une anomalie exclue les autres au diagnostic. Chacune de ces anomalies génétiques a fait l’objet du développement de petites molécules, qui s’administrent per os et qui cible spécifiquement chaque anomalie moléculaire. On appelle ce type de traitement, une thérapie ciblée car elle dirigée spécifiquement contre les cellules tumorales présentant un anomalie moléculaire spécifique comme une clé (thérapie ciblée) dirigée vers une serrure (cellule tumorale). Ces anomalies moléculaires surviennent essentiellement chez les patients non-fumeurs. 70% des CBNPC du non-fumeur vont présenter une de ces anomalies moléculaires (4). Alors que ces dernières ne représentent que 30% de tous CBNPC métastatiques en général peu importe le statu tabagique (5) (Figure 1). Les thérapies ciblées en plus d’offrir une option thérapeutique supplémentaire, sont plus efficaces en termes de taux de réponse objective, de survie sans progression et surtout avec une moindre toxicité en comparaison aux chimiothérapies standards à base de sels de platine (6). Ces thérapies ciblées sont ainsi devenues le traitement standard de première ligne des CBNPC métastatiques présentant une mutation activatrice de l’EGFR (Figure 2), un réarrangement ALK (Figure 3), ROS1, ou NTRK.
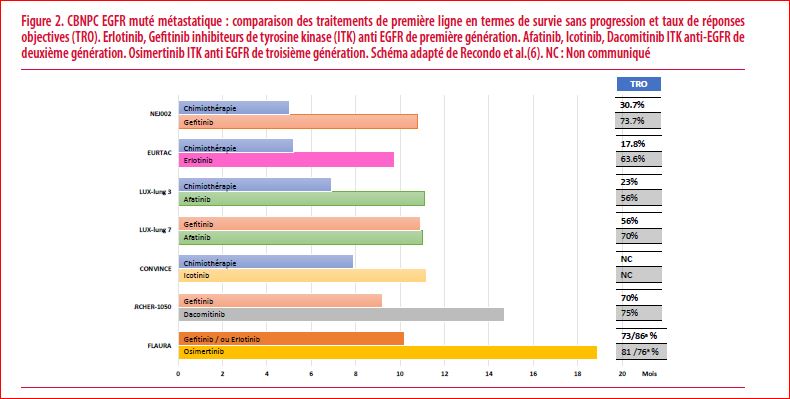
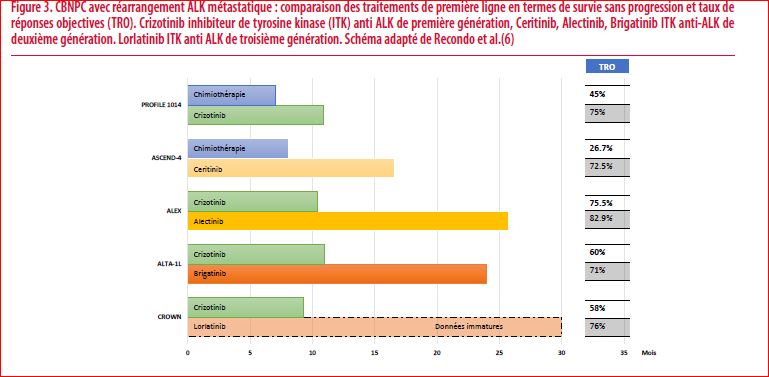
Le cancer du poumon est devenu le fer de lance de la médecine personnalisée et de précision en oncologie. La caractérisation spécifique de sous-groupes moléculaires par NGS est indispensable. Elle est définie par la présence, dans le tissu tumoral, d’une anomalie oncogénique qui prédit de l’efficacité aux inhibiteurs de kinase spécifiques. Par ailleurs, l’immunothérapie par les inhibiteurs de point de contrôle immunitaire (anti PD-L1 et anti PD-1) a une faible efficacité dans le CBNPC porteurs d’une anomalie moléculaire ciblable (7). D’autres anomalies moléculaires telles que la combinaison d’une mutation Serine/threonine kinase 11 (STK11) et Kirsten rat sarcoma viral oncogene (KRAS) en plus de signer l’agressivité d’un CBNPC est aussi associée à l’absence d’efficacité des anti PD-L1/PD-1 (8). La mutation KRAS G12C, localisée sur le codon 12 et aboutit à la substitution de l’acide aminé glycine(G) en acide aminé cystéine (C) a récemment bénéficiée du développement de petites molécules orales qui ciblent cette mutation en créant un pont disulfure avec la cystéine du codon 12 de la protéine KRAS inhibant ainsi son activité. Cette mutation KRAS G12C représente 46% des mutations KRAS dans le poumon (9). Des études cliniques de phase précoce ont donné de résultats encourageants (10) actuellement en cours d’évaluation dans des études de phase 3 en deuxième ligne dans les CNBPC porteurs de cette mutation.
Étant donné la grande efficacité et la bonne tolérance clinique de ces thérapies ciblées en première ligne des CBNPC métastatiques, ils sont actuellement en cours d’évaluation en adjuvant (après une chirurgie des maladies localisées) pour chaque anomalie moléculaire afin d’améliorer le taux de guérison et de survie globale. L’étude ADAURA est un essai randomisé de phase III en double aveugle, qui a inclus 682 CBNPC avec une mutation EGFR (délétion exon 19 ou mutation exon 21) de stade IB, II et IIIA opérés. Les patients prenaient de l’osimertinib 80 mg/jour ou un placebo. Au final , avec une réduction de 80% du risque de récidive à 2 ans en faveur de l’osimertinib (11), la Food and Drug Administration (FDA) a autorisée l’usage de l’osimertinib le 18 décembre 2020 dans cette indication malgré l’absence des données de survie. L’essor des NGS et l’évolution sans cesse croissante de leur sensibilité va dans le futur permettre de détecter avant le scanner les récidives et l’échappement au traitement, afin d’affiner nos stratégies thérapeutiques dans le futur proche.
Références
- Bray, F, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer J Clin. 2018. 68(6): p. 394-424.
- Travis, W.D, et al. The 2015 World Health Organization Classification of Lung Tumors: Impact of Genetic, Clinical and Radiologic Advances Since the 2004 Classification. J Thorac Oncol. 2015. 10(9): 1243-1260.
- Houston, KA, et al. Patterns in lung cancer incidence rates and trends by histologic type in the United States, 2004-2009. Lung Cancer. 2014. 86(1): 22-8.
- Couraud, S, et al. BioCAST/IFCT-1002: epidemiological and molecular features of lung cancer in never-smokers. Eur Respir J. 2015. 45(5): 1403-14.
- Barlesi, F, et al. Routine molecular profiling of patients with advanced non-small-cell lung cancer: results of a 1-year nationwide programme of the French Cooperative Thoracic Intergroup (IFCT). Lancet. 2016. 387(10026): p. 1415-1426.
- Recondo, G, et al. Making the first move in EGFR-driven or ALK-driven NSCLC: first-generation or next-generation TKI? Nat Rev Clin Oncol. 2018.
- Mazieres, J, et al. Immune checkpoint inhibitors for patients with advanced lung cancer and oncogenic driver alterations: results from the IMMUNOTARGET registry. Ann Oncol. 2019.
- Della Corte, CM, Byers LA. Evading the STING: LKB1 Loss Leads to STING Silencing and Immune Escape in KRAS-Mutant Lung Cancers. Cancer Discov. 2019. 9(1): p. 16-18.
- Moore, AR, et al. RAS-targeted therapies: is the undruggable drugged? Nature Rev Drug Discov. 2020. 19(8): p. 533-552.
- Hong, D.S, et al. KRASG12C Inhibition with Sotorasib in Advanced Solid Tumors. N Engl Jf Med. 2020. 383(13): p. 1207-1217.
- Wu, YL, et al. Osimertinib in Resected EGFR-Mutated Non–Small-Cell Lung Cancer. N Engl J Med. 2020. 383(18): p. 1711-1723.
Nouveautés dans le domaine de la mucoviscidose : traitements et pandémie COVID-19
Sophie Gohy, Silvia Berardis
En février 2016, un traitement fondamental de la mucoviscidose était remboursé pour la première fois en Belgique. L’Ivacaftor agit sur la protéine CFTR, déficiente dans cette maladie. CFTR est un canal à anions, principalement à chlorures, situé au pôle apical des cellules épithéliales. Il participe notamment à l’hydratation correcte des muqueuses. L’Ivacaftor augmente la probabilité d’ouverture du canal, ce qui lui permet de fonctionner correctement. Malheureusement, bien que ce traitement soit très efficace (VEMS + 10%), il est réservé aux patients ayant une mutation de classe 3, ce qui représente seulement 4% des patients belges atteints de mucoviscidose (1). Depuis 11/2019, est approuvé par la FDA (et par l’EMA en 2020), l’association d’Ivacaftor, de Tezacaftor et d’Elexacaftor qui est plus efficace encore (VEMS + 14%) et qui concerne 87 % des patients belges dans le registre 2018 (2, 3). En Belgique, il n’est malheureusement pas encore remboursé, notamment vu le coût prohibitif. L’espérance de vie de nos patients va clairement augmenter dans le futur et tous les patients attendent ce médicament avec beaucoup d’espoir et d’impatience, en espérant que les négociations entre le gouvernement et la firme aboutissent rapidement car des vies sont en jeu.
Concernant la pandémie à coronavirus, les patients atteints de mucoviscidose représentent un groupe à risque. Récemment publié, le taux de mortalité chez les patients non-greffés présentant une COVID-19 est de 2% (âge moyen 24 ans) et chez les transplantés pulmonaires, de 12,5% (âge moyen 38 ans) (4). D’autres facteurs de mauvais pronostic tels que l’âge, l’hypertension artérielle, le diabète et les autres maladies respiratoires chroniques (5) (notamment la bronchopneumopathie chronique obstructive et les pathologies interstitielles diffuses) augmentent le risque de mortalité (6, 7). Dans ce contexte, à la fin de la première vague, nous avons voulu évaluer chez nos patients atteints de mucoviscidose la séroprévalence pour ce virus.
149 patients ont effectué une prise de sang pour doser les IgG et IgM anti-SARS-CoV2 et ont été contactés par téléphone pour récolter les symptômes mineurs et/ou majeurs liés à la maladie afin de détecter les cas possibles. 36 patients ont été considérés comme des cas possibles (ils n’ont pas été hospitalisés, ni testés par PCR à cette époque). Un seul des cas possibles a été hospitalisé et confirmé positif par PCR. La présence d’anticorps n’a été détectée chez aucun de ces patients. Le délai moyen entre l’apparition des symptômes et le dosage des anticorps était de 44,1 ± 17,4 jours. Seulement 3 patients asymptomatiques présentaient des IgG anti-SARS-CoV-2 (8).
En conclusion, la mucoviscidose rend le diagnostic de la COVID-19 difficile car les symptômes d’exacerbation respiratoire et de la COVID-19 présentent des similitudes. La généralisation des tests PCR, non disponibles à l’époque, facilite le diagnostic actuellement. Peu de patients se sont infectés lors de la première vague, reflétant l’effet bénéfique potentiel d’un confinement précoce chez nos patients et du respect des gestes barrière (mesures de distanciation/port du masque/hygiène des mains). Le rôle de l’azithromycine reste quant à lui encore débattu.
Références
- Ramsey BW, Davies J, McElvaney NG, Tullis E, Bell SC, Drevinek P, et al; Group VXS. A CFTR potentiator in patients with cystic fibrosis and the G551D mutation. N Engl J Med. 2011; 365: 1663-1672.
- Middleton PG, Mall MA, Drevinek P, Lands LC, McKone EF, Polineni D, et al.; Group VXS. Elexacaftor-Tezacaftor-Ivacaftor for Cystic Fibrosis with a Single Phe508del Allele. N Engl J Med. 2019; 381: 1809-1819.
- Heijerman HGM, McKone EF, Downey DG, Van Braeckel E, Rowe SM, Tullis E, et al.; Group VXT. Efficacy and safety of the elexacaftor plus tezacaftor plus ivacaftor combination regimen in people with cystic fibrosis homozygous for the F508del mutation: a double-blind, randomised, phase 3 trial. Lancet. 2019; 394: 1940-1948.
- McClenaghan E, Cosgriff R, Brownlee K, Ahern S, Burgel PR, Byrnes CA, et al. The global impact of SARS-CoV-2 in 181 people with cystic fibrosis. J Cyst Fibros. 2020; 19: 868-871.
- Wu C, Chen X, Cai Y, Xia J, Zhou X, Xu S, et al. Risk Factors Associated With Acute Respiratory Distress Syndrome and Death in Patients With Coronavirus Disease 2019 Pneumonia in Wuhan, China. JAMA Intern Med. 2020; 180: 934-943.
- Leung JM, Niikura M, Yang CWT, Sin DD. COVID-19 and COPD. Eur Respir J. 2020; 56.
- Drake TM, Docherty AB, Harrison EM, Quint JK, Adamali H, Agnew S, et al.; Investigators IC. Outcome of Hospitalization for COVID-19 in Patients with Interstitial Lung Disease. An International Multicenter Study. Am J Respir Crit Care Med. 2020; 202: 1656-1665.
- Berardis S, Verroken A, Vetillart A, Struyf C, Gilbert M, Gruson D, Gohy S. SARS-CoV-2 seroprevalence in a Belgian cohort of patients with cystic fibrosis. J Cyst Fibros. 2020; 19: 872-874.
L’asthme sévère en 2020 : à l’aube du dupilumab
Charles Pilette
L’asthme sévère représente un défi diagnostic : 24% des patients asthmatiques sont sous un traitement maximal (niveau GINA 4-5), 17% restent mal contrôlés malgré celui-ci, mais seuls 3.7% sont considérés comme ayant un asthme sévère (1). Les autres patients présentent un asthme dit difficile, dont le manque de contrôle peut être dû à différents facteurs, parfois combinés, interférant avec le contrôle de la maladie comme un diagnostic additionnel (hyperventilation, pathologie naso-sinusienne, dysfonction laryngée), une adhérence ou une technique d’inhalation incorrecte, une exposition persistante à des allergènes ou à des irritants (tabac), un reflux gastro-oesophagien, une obésité ou des problèmes psycho-sociaux. Le référencement de ces patients à partir de la première ligne constitue une étape importante à certainement améliorer dans notre pays (2) afin de limiter le recours à la corticothérapie orale (en maintenance, et/ou en cures répétées) dont les effets systémiques néfastes peuvent être majeurs à moyen terme (e.p. risque cardio-vasculaire, métabolique, osseux, endocrinien, cutané et infectieux) dès une dose cumulée d’environ 1 gramme d’équivalent prednisone.
L’asthme « T2 » (avec immunopathologie de type 2) est un prototype du succès de la recherche médicale de transfert. Les biologiques ciblés sur l’interleukine (IL-5) ou son récepteur (mepolizumab et benralizumab) sont désormais disponibles sous forme auto-injectable, pour les patients affectés d’une forme confirmée sévère (ce qui requiert une prise en charge spécialisée pendant au moins 6 mois) et caractérisée par des exacerbations ou poussées aigües et dont le trait éosinophilique prédomine (éosinophiles sanguins ≥ 300/uL à plusieurs reprises, avec typiquement polypose nasale ou hypersensibilité à l’aspirine/AINS, voire une forme syndromique comme une ABPA (3) ou une vasculite de Churg-Strauss). Les patients avec asthme sévère caractérisé par un profil inflammatoire éosinophilique (≥ 150/uL) et/ou avec un NO expiré élevé (≥ 25ppb) pourront également bientôt bénéficier du dupilumab (DUPIXENT). Cet anticorps humanisé dirigé contre le récepteur de l’IL-4, bloquant l’activité des cytokines IL-4 et IL-13 (se partageant ce récepteur) sur les cellules épithéliales (production de mucus et d’oxide nitrique) et musculaires lisses (hyperréactivité) et sur les lymphocytes T (polarisation Th2) et B (production d’IgE), est déjà utilisé par nos collègues dermatologues pour traiter la dermatite atopique sévère (4). Il offre en principe - outre son effet préventif sur les exacerbations sévères (réduites en moyenne de 50%) et d’épargne cortisonée (5) - l’avantage d’une efficacité supérieure aux biologiques anti-IL-5(R) quant à l’amélioration de la fonction respiratoire (400 mL vs 100 à 150 mL pour les anti-IL-5(R)) et des comorbidités (polypose naso-sinusienne ainsi que dermatite atopique), indépendamment du statut fonctionnel initial ou de la dose de la corticothérapie inhalée de maintenance (6). Par contre, si l’élévation de l’éosinophilie qui est parfois observée sous ce traitement reste souvent modérée et asymptomatique, une précaution pourrait devoir s’imposer chez les patients avec phénotype initial fortement éosinophilique (> 1.000/uL) en fonction de l’évidence dans les études de surveillance à plus long terme. Il n’y a actuellement pas d’évidence clinique de précaution particulière quant à l’utilisation de ces traitements biologiques de l’asthme (anti-IgE, anti-IL-5(R), anti-IL4R) en regard du risque ou des conséquences de l’infection par le SARS-CoV-2 chez les patients avec asthme sévère (7, 8).
Chez les patients avec asthme sévère mais non éligibles à un biologique (p.ex. avec phénotype pauci-exacerbateur ou pauci-inflammatoire), l’addition d’un antimuscarinique à longue durée d’action (LAMA) au traitement de fond ICS-LABA est facilitée dans notre pays depuis avril 2020 (prescription en catégorie B). Si l’avènement de la trithérapie inhalée ICS-LABA-LAMA dans un même inhalateur représente une avancée pour les patients avec BPCO sévère compliquée d’exacerbations fréquentes, son introduction dans l’asthme doit se faire de manière ciblée, en tenant compte d’un bénéfice beaucoup plus modeste des LAMA dans l’asthme (essentiellement significatif en terme d’amélioration fonctionnelle respiratoire) et que la corticothérapie inhalée (et sa posologie titrée) reste la pierre angulaire du traitement de cette maladie. L’intérêt le plus évident des LAMA dans l’asthme est le chevauchement avec une BPCO (9), c’est-à-dire d’un trouble ventilatoire obstructif fixé.
L’année 2020 et sa pandémie COVID-19 aura illustré les défis de la prise en charge de l’asthme, à savoir l’aspect crucial de l’interaction entre acteurs des soins (e.a. médecin généraliste et spécialiste), la prise en charge et le traitement « énergique » des cofacteurs et comorbidités influençant son contrôle, ainsi que la décision – pour une minorité de patients bien sélectionnés, avec maladie sévère – de traitement biologique dont l’administration est désormais facilitée (pour la plupart) par des stylos auto-injecteurs.
Références
- Global Initiative for Asthma (GINA), https://ginasthma.org/ dernier accès le 31/01/2020.
- Cataldo D, Louis R, Michils A, Peché R, Pilette C, Schleich F, Ninane V, Hanon S. Severe asthma: oral corticosteroid alternatives and the need for optimal referral pathways. J Asthma. 2020 Jan 11:1-11. doi: 10.1080/02770903.2019.1705335. Online ahead of print.
- Schleich F, Vaia ES, Pilette C, Vandenplas O, Halloy JL, Michils A, et al. Mepolizumab for allergic bronchopulmonary aspergillosis: Report of 20 cases from the Belgian Severe Asthma Registry and review of the literature. J Allergy Clin Immunol Pract. 2020 Jul-Aug;8(7):2412-2413.e2. doi: 10.1016/j.jaip.2020.03.023. Epub 2020 Apr 5.
- Cheraghlou S, Cohen JM, Cheraghlou S, et al. Early Adoption of Dupilumab in the Medicare Population in 2017. Yale J Biol Med. 2020 Dec 29;93(5):675-677.
- Corren J, Castro M, O’Riordan T, Hanania NA, Pavord ID, Quirce S, et al. J Allergy Clin Immunol Pract. 2020 Feb;8(2):516-526. doi: 10.1016/j.jaip.2019.08.050. Epub 2019 Sep 12. Dupilumab Efficacy in Patients with Uncontrolled, Moderate-to-Severe Allergic Asthma. J Allergy Clin Immunol Pract. 2020. PMID: 31521831 Free article.
- Pavord ID, Siddiqui S, Papi A, Corren J, Sher LD, Bardin P, et al. Dupilumab Efficacy in Patients Stratified by Baseline Treatment Intensity and Lung Function. J Asthma Allergy. 2020 Dec 16;13:701-711.
- Hanon S, Brusselle G, Deschampheleire M, Louis R, Michils A, Peché R, Pilette C et al. COVID-19 and biologics in severe asthma: data from the Belgian Severe AsthmaRegistry. Eur Respir J. 2020 Oct 22;56(6):2002857. doi: 10.1183/13993003.02857-2020. Online ahead of print.
- Bhalla A, Mukherjee M, Radford K, Nazy I, Kjarsgaard M, Bowdish DME, et al. Dupilumab, severe asthma airway responses, and SARS-CoV-2 serology. Allergy. 2020 Aug 6:10.1111/all.14534. doi: 10.1111/all.14534. Online ahead of print.
- Kaplan A, FitzGerald JM, Buhl R, Vogelberg C, Hamelmann E, Kaplan A, et al. Comparing LAMA with LABA and LTRA as add-on therapies in primary care asthma management. NPJ Prim Care Respir Med. 2020 Nov 11;30(1):50. doi: 10.1038/s41533-020-00205-9.
- Graff S, Vanwynsberghe S, Brusselle G, Hanon S, Sohy C, Dupont LJ, et al. Chronic oral corticosteroids use and persistent eosinophilia in severe asthmatics from the Belgian severe asthma registry. Respir Res. 2020 Aug 12;21(1):214. doi: 10.1186/s12931-020-01460-7.
Pneumopathies infiltrantes diffuses – nouveautés 2020
Antoine Froidure
Le service de pneumologie des Cliniques Saint-Luc est toujours très actif dans le domaine des pneumopathies interstitielles et des fibroses pulmonaires, avec cette année encore et malgré la pandémie près de 180 nouveaux patients discutés en réunion multidisciplinaire.
À l’instar des autres domaines de la pneumologie, on assiste à une amélioration de la personnalisation des traitements des maladies interstitielles. Ainsi, le service de pneumologie des CUSL a coordonné une cohorte nationale démontrant l’intérêt du mépolizumab, un anticorps anti-IL-5 indiqué dans l’asthme sévère, comme traitement des pneumopathies chroniques idiopathiques à éosinophiles (1). Nous avons également participé à un registre européen dont le but était d’étudier l’effet des médicaments antifibrosants chez les patients souffrant de fibrose pulmonaire liée à une mutation d’un gène du complexe télomérase (2). La longueur des télomères est non seulement un facteur pronostic important des fibroses pulmonaires (3), mais également un des éléments liés à l’évolution du COVID-19, comme démontré par nos récents travaux réalisés en collaboration avec le Professeur Anabelle Decottignies (Institut de Duve, UCLouvain) : lors de la première vague (entre le 7 avril et le 27 mai 2020), nous avons mesuré , grâce à une technique appelée FlowFISH, la longueur des télomères de 70 patients hospitalisés aux Cliniques universitaires Saint-Luc pour une infection COVID-19. La taille des télomères de cette population a été comparée aux résultats d’un groupe témoin, près de 500 personnes non-atteintes de la COVID-19. Dans la cohorte des patients COVID-19, les télomères se sont avérés plus courts par rapport au groupe de référence. L’étude a aussi mis en évidence que le fait d’avoir des télomères très courts (de taille inférieure au percentile 10 pour l’âge) était associé à un risque significativement plus élevé d’admission aux soins intensifs ou de décès. Cette étude, dont les résultats ont été publiés dans le journal américain Aging (4), ouvre des perspectives importantes dans la compréhension des mécanismes de l’immunité vis-à-vis du coronavirus.
Références
- Brenard E, Pilette C, Dahlqvist C, Colinet B, Schleich F, Roufosse F, Froidure A. Real-Life Study of Mepolizumab in Idiopathic Chronic Eosinophilic Pneumonia. Lung. 2020 Apr;198(2):355-360. doi: 10.1007/s00408-020-00336-3. Epub 2020 Feb 12.
- Justet A, Klay D, Porcher R, Cottin V, Ahmad K, Molina Molina M, et al; OrphaLung Network. Safety and efficacy of pirfenidone and nintedanib in patients with Idiopathic Pulmonary Fibrosis and carrying a telomere related gene mutation. Eur Respir J. 2020 Nov 19:2003198. doi: 10.1183/13993003.03198-2020. Online ahead of print.
- Planté-Bordeneuve T, Poiré X, De Leener A, Froidure A. Fibroses pulmonaires familiales et téloméropathies. Louvain Med. 2019 ; Louvain Med. 2019; 138 (7): 431-438.
- Froidure A, Mahieu M, Hoton D, Laterre PF, Yombi JC, Koenig S, et al. Short telomeres increase the risk of severe COVID-19. Aging (Albany NY). 2020 Oct 26;12(20):19911-19922. doi: 10.18632/aging.104097. Epub 2020 Oct 26.
Correspondance
Pr. Charles Pilette
Cliniques universitaires Saint-Luc
Pneumologie Avenue Hippocrate 10
B-1200 Bruxelles