Variants génétiques dans le gène codant pour l’Apolipoprotéine L1 et maladies rénales
Michel Jadoul, Arnaud Devresse
La prévalence beaucoup plus élevée de maladie rénale chronique chez les Afro-Américains que chez les américains de souche européenne a retenu l’attention de longue date. En 2010 des chercheurs de Boston ont identifié deux variants appelés G1 et G2 dans le gène de l’apolipoprotéine L1. Ces variants sont apparus il y a plusieurs milliers d’années en Afrique de l’Ouest et leur fréquence est élevée dans cette région (et chez les descendants de sujets originaires de cette région, nombreux aux USA, aux Caraïbes et au Brésil). G1 et G2 confèrent une résistance vis-à-vis des trypanosomes et protègent donc de la maladie du sommeil. Ce net avantage évolutif est une explication hautement vraisemblable de leur persistance et leur prévalence élevée, au prix d’un risque accru de maladie rénale chronique. Le risque de certaines maladies glomérulaires comme la néphropathie due au VIH et l’hyalinose segmentaire et focale est multiplié par 30 ou plus chez les homozygotes G1 ou G2 ou les hétérozygotes composites G1-G2.
Fort heureusement, même si les mécanismes fins de la toxicité de G1 et G2 sur les cellules rénales restent discutés, plusieurs molécules sont en cours de développement pour traiter la maladie rénale chronique associée aux variants G1 et G2 de l’apoL1.
Ainsi, l’inaxaplin, une petite molécule administrée par voie orale a démontré in vitro une nette inhibition de l’activité de ApoL1, puis in vivo chez une souris génétiquement modifiée exprimant le variant ApoL1 à risque, une baisse de la protéinurie. De surcroît, l’administration d’inaxaplin à une cohorte de 16 patients a permis à court terme une réduction d’environ 50 % de l’albuminurie. Ces travaux, malgré leur caractère préliminaire, ont été publiés dans le New England Journal of Medicine (1). Cette nette réduction de la protéinurie permet d’espérer un effet néphroprotecteur à moyen terme. Un essai de phase 3 vient de démarrer pour tester cette hypothèse. Le service de néphrologie des Cliniques universitaires Saint-Luc est le seul centre francophone Belge qui y participe. Plusieurs autres molécules seront testées dans les prochains mois ou années.
Dès lors, le message pour tout clinicien qui voit un patient ayant des ancêtres originaires d’Afrique subsaharienne et atteint de maladie rénale chronique est clair : la recherche des variants G1/G2 s’impose (au moyen d’une simple prise de sang pour extraire l’ADN, le génotypage est remboursé par l’INAMI), pour ne pas manquer l’occasion de bénéficier de ce traitement innovant en participant aux essais cliniques qui démarrent. L’identification de ces variants a aussi d’autres implications (conseil génétique, sélection des candidats donneur de transplantation rénale, etc.). Le service sera ravi d’aider au dépistage des sujets atteints de MRC et originaires d’Afrique subsaharienne (contact : Prs. Arnaud Devresse et Michel Jadoul : arnaud.devresse@saintluc.uclouvain.be et michel.jadoul@saintluc.uclouvain.be).
Référence
- Egbuna O, Zimmerman B, Manos G, Fortier A, Chirieac MC, Dakin LA, et al. ; VX19-147-101 Study Group.Inaxaplin for Proteinuric Kidney Disease in Persons with Two APOL1 Variants. N Engl J Med. 2023; 388(11):969-979. doi: 10.1056/NEJMoa2202396.PMID: 36920755
Roxadustat, une révolution dans la prise en charge de l’anémie liée à la maladie rénale chronique ?
Elliott Van Regemorter, Eric Goffin, Laura Labriola
Anémie et maladie rénale chronique : épidémiologie, pathophysiologie et prise en charge historique
La maladie rénale chronique (MRC) est une pathologie très fréquente, affectant en moyenne plus d’une personne sur 10 mondialement (1). Une des complications les plus fréquentes qui en résulte est l’anémie, dont la prévalence augmente avec la progression de la MRC, atteignant déjà 43% des patients présentant une MRC de stade G3b et jusqu’à 90% des patients en dialyse péritonéale (DP) et 95% des patients en hémodialyse chronique (HD) (2). L’anémie liée à la MRC est associée à une diminution de la qualité de vie, une progression plus rapide de la MRC et une majoration de la mortalité toute cause (3).
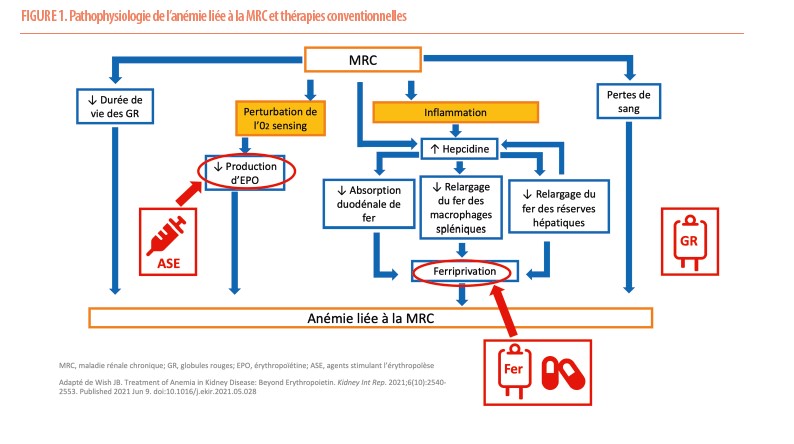
La prise en charge thérapeutique de cette anémie liée à la MRC avait peu changé sur les trois dernières décennies et se basait classiquement sur l’optimisation des réserves martiales par voie per os ou IV, la correction de la déficience en érythropoïétine (EPO) par administration d’agents stimulant l’érythropoïèse (ASE) et la transfusion de globules rouges en dernier recours (4). Cette approche thérapeutique axée sur la supplémentation n’adresse pas la pathophysiologie complexe de l’anémie liée à la MRC (Figure 1), et peut exposer les patients nécessitant des doses croissantes d’ASE et de supplémentation martiale à un risque majoré de survenue d’évènements cardiovasculaires et de surcharge en fer (5,6).
L’anémie liée à la MRC s’articule autour de deux phénomènes centraux qui sont l’inflammation et la perturbation de la détection d’oxygène au niveau rénal ou « oxygen sensing ». Tout d’abord, l’inflammation chronique de bas grade dont souffrent les patients atteints de MRC cause, au-delà d’effets inhibiteurs directs sur la différenciation des cellules érythroïdes, une majoration de l’hepcidine, renforcée par une diminution de sa clairance rénale. Cette élévation de l’hepcidine entraîne par la suite un état de carence martiale absolue et fonctionnelle par diminution de l’absorption duodénale en fer, diminution du relargage de fer contenu dans les macrophages spléniques mais également des réserves martiales hépatiques, occasionnant secondairement une majoration de la production hépatique d’hepcidine. Le deuxième phénomène important à l’origine de cette anémie liée à la MRC est la notion de perturbation de l’« oxygen sensing ». (7)
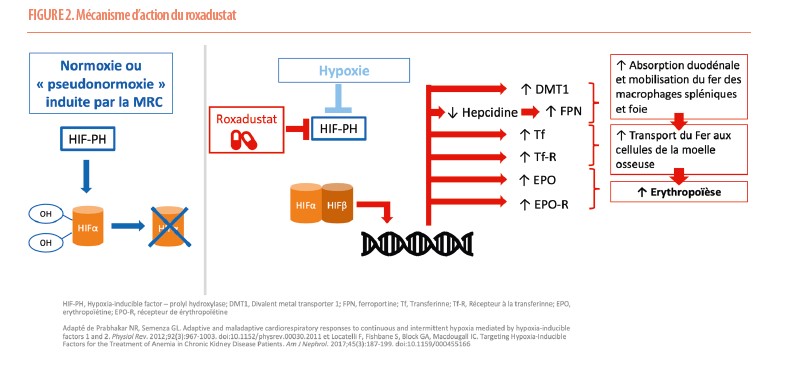
Roxadustat, Hypoxia-inducible factor (HIF) et « oxygen sensing » : mécanisme d’action
HIF est un facteur de transcription impliqué dans l’érythropoïèse dont la fonctionnalité nécessite la présence de deux sous-unités : une sous-unité α dont la présence est hypoxie dépendante et la sous-unité β qui est exprimée de façon constitutive. En condition de normoxie, l’enzyme appelée HIF Prolyl Hydoxylase (HIF-PH) va hydroxyler HIFα, ce qui entraîne donc son ubiquitination et dégradation via le protéasome. En condition d’hypoxie (comme en altitude), l’activité de HIF-PH est diminuée, permettant la stabilisation de HIFα, sa translocation dans le noyau et son association avec la sous-unité β. Cet hétérodimère actif entraîne ensuite la transcription de plusieurs gènes menant à une majoration de l’absorption duodénale de fer, une mobilisation du fer contenu dans les macrophages spléniques et des réserves martiales hépatiques, une optimisation du transport de fer aux cellules de la moelle osseuse et une stimulation de l’érythropoïèse. Suite aux anomalies structurelles liées à la MRC, ce phénomène d’« oxygen sensing » est déficient, ce qui mène à un état de « pseudonormoxie » où l’HIF-PH reste anormalement active. Le roxadustat permet de rétablir l’activation de cette réponse coordonnée sur l’érythropoïèse HIF-dépendante, en inhibant de manière réversible l’enzyme HIF-PH (Figure 2). (8,9)
Etudes de phase 3 : données sur l’efficacité et la sécurité
L’efficacité du roxadustat a été évaluée dans un programme combiné d’études de phase 3 appelé ALPINE, qui a inclus un total de 9600 patients adultes atteints de MRC et présentant une anémie symptomatique, au travers de 8 études (10).
Chez les patients adultes non dialysés, trois études multicentriques, randomisées et en double aveugle ont d’abord montré l’efficacité du roxadustat pour atteindre et maintenir la cible souhaitée d’hémoglobine comparé au placebo (ALPS, OLYMPUS et ANDES) (11-13). Dans le même type de population, une étude randomisée contrôlée ouverte a ensuite permis de montrer la non infériorité du roxadustat comparé à un ASE, la darbepoetin alfa (DOLOMITES) (14). Finalement, quatre études multicentriques contrôlées ouvertes comparant le roxadustat à un ASE (epoetin alfa ou darbepoetin alfa) ont permis de démontrer la non infériorité du roxadustat pour atteindre et maintenir l’hémoglobine cible chez des patients dialysés (HD et DP) incidents (HIMALAYAS), prévalents (PYRENEES) ou incidents et prévalents (ROCKIES et SIERRAS) (15-18). De manière intéressante, une étude groupant les résultats de tous les patients dialysés prévalents a montré que la dose de roxadustat nécessaire pour maintenir l’hémoglobine à la cible pendant une durée de 2 ans était inchangée, alors que des doses progressivement croissantes d’ASE étaient nécessaires pour atteindre la même cible (19). Par ailleurs, une analyse exploratoire a montré chez les patients dialysés ou non dialysés et bénéficiant du traitement par roxadustat, une majoration du fer sérique et de la capacité totale de fixation du fer, accompagnée d’une diminution de l’hepcidine et de la ferritine et que ces patients avaient donc un besoin réduit en supplémentation martiale (20). Un autre avantage de cette amélioration des paramètres martiaux est que l’efficacité du roxadustat est indépendante de la CRP au baseline avec une dose nécessaire pour atteindre l’hémoglobine cible totalement stable au cours du temps, au contraire de ce que l’on peut observer avec les ASE (18). Finalement, une réduction du cholestérol LDL a également été mise en évidence chez les patients ayant bénéficié du roxadustat en comparaison avec un ASE. Une hypothèse évoquée serait que la dégradation hépatique de l’HMG-CoA réductase serait accélérée par une activation HIF-dépendante de la transcription de l’insulin-induced gene 2 (INSIG2), favorisée par l’action du roxadustat (21).
Le profil de sécurité du roxadustat était comparable à celui des ASE à travers les différentes études de phase 3 citées ci-dessus, et reflétait le profil des patients atteints de MRC (10). Les analyses groupées n’ont pas montré de majoration significative du risque d’évènements cardiovasculaires ou de mortalité toute cause chez les patients non dialysés ou dialysés incidents et prévalents, traités avec roxadustat et ce comparé aux ASE (22,23). Cependant, chez un groupe de patients dialysés prévalents qui étaient sous ASE au baseline et qui ont donc été convertis au roxadustat, un risque majoré d’évènements cardiovasculaires et de mortalité tout cause a été montré par rapport au groupe de patients qui étaient restés sous traitement par ASE (19). Il n’est pas exclu que ces résultats soient imputables au risque inhérent à un changement de traitement chez des patients initialement sous dose stable d’ASE, les exposant notamment à une variation abrupte d’hémoglobine. Néanmoins, ces résultats sont à l’origine de la recommandation de ne pas relayer un ASE par le roxadustat chez des patients dialysés prévalents en l’absence d’une raison clinique valable (10). Finalement, notons l’absence de différence dans l’incidence de survenue ou de progression d’hémorragie rétinienne mais également dans l’incidence de néoplasie dans le groupe traité par roxadustat comparé aux ASE ; deux pathologies dont la genèse ou la progression semblent étroitement liées à la voie HIF (17,18,22,24). En effet, l’activation de la voie HIF par le roxadustat est non seulement réversible mais également intermittente et mime donc la réponse physiologique de l’organisme à l’hypoxie (8). Par ailleurs, certaines études randomisées contrôlées ont notamment montré qu’il n’y avait pas de différence significative dans les niveaux sériques de VEGF (vascular endothelial growth factor) entre les groupes traités par inhibiteur de HIF-PH et le groupe contrôle (placebo ou ASE) chez des patients dialysés ou non (25).
Conditions de remboursement en Belgique
Le roxadustat est le seul inhibiteur de HIF-PH qui ait été approuvé par l’agence européenne des médicaments pour le traitement de l’anémie symptomatique lié à la MRC. Il est disponible et remboursé en Belgique depuis le 1er janvier 2024 aux conditions suivantes (Tableau) :

Conclusions
Le roxadustat est le premier traitement disponible en Belgique adressant la physiopathologie complexe de l’anémie en MRC, qui s’articule autour de l’inflammation chronique de bas grade avec ferriprivation et dysfonction de l’« oxygen sensing ». Il permet la restauration d’une érythropoïèse coordonnée avec un maintien de l’hémoglobine dans les cibles, sans majoration progressive de la dose au cours du temps, indépendamment de l’inflammation au baseline et ce avec un profil de sécurité comparable aux ASE. Par ailleurs, l’amélioration des paramètres martiaux qui en découle entraîne une diminution des besoins de supplémentation en fer IV ou per os et nécessitera probablement une adaptation des objectifs classiques de paramètres martiaux à atteindre en dialyse.
Lors de l’instauration d’un traitement pour anémie symptomatique liée à la MRC, le choix du roxadustat ou d’un ASE devra être discuté avec le patient en fonction de ses souhaits et de son profil. Les autres avantages du roxadustat par rapport aux ASE comprennent un stockage à température ambiante, une formulation orale limitant les injections sous-cutanée, une préservation du capital veineux de par la diminution des besoins en fer IV chez les patients non dialysés ou en DP et une efficacité possiblement supérieure aux ASE en contexte inflammatoire. A noter que des effets « off-target » éventuels des inhibiteurs de HIF-PH ne sont pas encore exclus au vu de l’expérience à long terme limitée, notamment sur la progression de néoplasies, de rétinopathie diabétique ou maculopathie, de l’hypertension artérielle pulmonaire, de la taille des kystes dans la polykystose rénale et sur la survenue d’hypothyroïdie centrale (26).
Références
- Hill NR, Fatoba ST, Oke JL, Hirst JA, O’Callaghan CA, Lasserson DS et al. Global Prevalence of Chronic Kidney Disease - A Systematic Review and Meta-Analysis. PLoS One. 2016; 11(7):e0158765. Published 2016 Jul 6. doi:10.1371/journal.pone.0158765
- Evans M, Bower H, Cockburn E, Jacobson SH, Barany P, Carrero JJ. Contemporary management of anaemia, erythropoietin resistance and cardiovascular risk in patients with advanced chronic kidney disease: a nationwide analysis. Clin Kidney J. 2020;13(5):821-827. Published 2020 May 1. doi:10.1093/ckj/sfaa054
- Hoshino J, Muenz D, Zee J, Sukul N, Speyer E, Guedes M et al. Associations of Hemoglobin Levels With Health-Related Quality of Life, Physical Activity, and Clinical Outcomes in Persons With Stage 3-5 Nondialysis CKD. J Ren Nutr. 2020; 30(5):404-414. doi:10.1053/j.jrn.2019.11.003
- KDIGO. Kidney Int Suppl. 2012; 4:279–335. doi:10.1038/kisup.2012.37
- Koulouridis I, Alfayez M, Trikalinos TA, Balk EM, Jaber BL. Dose of erythropoiesis-stimulating agents and adverse outcomes in CKD: a metaregression analysis. Am J Kidney Dis. 2013; 61(1):44-56. doi:10.1053/j.ajkd.2012.07.014
- Lee KH, Ho Y, Tarng DC. Iron Therapy in Chronic Kidney Disease: Days of Future Past. Int J Mol Sci. 2021; 22(3):1008. Published 2021 Jan 20. doi:10.3390/ijms22031008
- Wish JB. Treatment of Anemia in Kidney Disease: Beyond Erythropoietin. Kidney Int Rep. 2021; 6(10):2540-2553. Published 2021 Jun 9. doi:10.1016/j.ekir.2021.05.028
- Locatelli F, Fishbane S, Block GA, Macdougall IC. Targeting Hypoxia-Inducible Factors for the Treatment of Anemia in Chronic Kidney Disease Patients. Am J Nephrol. 2017; 45(3):187-199. doi:10.1159/000455166
- Prabhakar NR, Semenza GL. Adaptive and maladaptive cardiorespiratory responses to continuous and intermittent hypoxia mediated by hypoxia-inducible factors 1 and 2. Physiol Rev. 2012; 92(3):967-1003. doi:10.1152/physrev.00030.2011
- Astellas. Roxadustat Summary of Product Characteristics.
- Shutov E, Sułowicz W, Esposito C, et al. Roxadustat for the treatment of anemia in chronic kidney disease patients not on dialysis: a Phase 3, randomized, double-blind, placebo-controlled study (ALPS). Nephrol Dial Transplant. 2021; 36(9):1629-1639. doi:10.1093/ndt/gfab057
- Fishbane S, El-Shahawy MA, Pecoits-Filho R, Van BP, Houser MT, Frison L et al. Roxadustat for Treating Anemia in Patients with CKD Not on Dialysis: Results from a Randomized Phase 3 Study. J Am Soc Nephrol. 2021; 32(3):737-755. doi:10.1681/ASN.2020081150
- Coyne DW, Roger SD, Shin SK, Kim SG, Cadena AA, Moustafa MA, et al. Roxadustat for CKD-related Anemia in Non-dialysis Patients. Kidney Int Rep. 2020; 6(3):624-635. Published 2020 Dec 5. doi:10.1016/j.ekir.2020.11.034
- Barratt J, Andric B, Tataradze A, Schömig M, Reusch M, Valluri U et al. Roxadustat for the treatment of anaemia in chronic kidney disease patients not on dialysis: a Phase 3, randomized, open-label, active-controlled study (DOLOMITES) (published correction appears in Nephrol Dial Transplant. 2022 Mar 25;37(4):805). Nephrol Dial Transplant. 2021; 36(9):1616-1628. doi:10.1093/ndt/gfab191
- Provenzano R, Shutov E, Eremeeva L, Korneyeva S, Poole L, Saha G , et al. Roxadustat for anemia in patients with end-stage renal disease incident to dialysis. Nephrol Dial Transplant. 2021; 36(9):1717-1730. doi:10.1093/ndt/gfab051
- Csiky B, Schömig M, Esposito C, Barrat J, Reusch M, Valluri U et al. Roxadustat for the Maintenance Treatment of Anemia in Patients with End-Stage Kidney Disease on Stable Dialysis: A European Phase 3, Randomized, Open-Label, Active-Controlled Study (PYRENEES). Adv Ther. 2021; 38(10):5361-5380. doi:10.1007/s12325-021-01904-6
- Fishbane S, Pollock CA, El-Shahawy M, Escudero ET, Rastogi A, Van BP et al. Roxadustat Versus Epoetin Alfa for Treating Anemia in Patients with Chronic Kidney Disease on Dialysis: Results from the Randomized Phase 3 ROCKIES Study. J Am Soc Nephrol. 2022; 33(4):850-866. doi:10.1681/ASN.2020111638
- Charytan C, Manllo-Karim R, Martin ER, Steer D, Bernardo M, Dua SL et al. A Randomized Trial of Roxadustat in Anemia of Kidney Failure: SIERRAS Study. Kidney Int Rep. 2021; 6(7):1829-1839. Published 2021 Apr 17. doi:10.1016/j.ekir.2021.04.007
- Barratt J, Sulowicz W, Schömig M, et al. Efficacy and Cardiovascular Safety of Roxadustat in Dialysis-Dependent Chronic Kidney Disease: Pooled Analysis of Four Phase 3 Studies. Adv Ther. 2021; 38(10):5345-5360. doi:10.1007/s12325-021-01903-7
- Pergola PE, Charytan C, Little DJ, Tham S, Szczech L, Leong R et al. Changes in Iron Availability with Roxadustat in Nondialysis- and Dialysis-Dependent Patients with Anemia of CKD. Kidney360. 2022; 3(9):1511-1528. Published 2022 Jun 29. doi:10.34067/KID.0001442022
- Hirai K, Kaneko S, Minato S, Yanai K, Hirata M, Kitano T et al. Effects of roxadustat on anemia, iron metabolism, and lipid metabolism in patients with non-dialysis chronic kidney disease. Front Med (Lausanne). 2023; 10:1071342. Published 2023 Feb 22. doi:10.3389/fmed.2023.1071342
- Provenzano R, Szczech L, Leong R, Saikali KG, Zhong M, Lee TT et al. Efficacy and Cardiovascular Safety of Roxadustat for Treatment of Anemia in Patients with Non-Dialysis-Dependent CKD: Pooled Results of Three Randomized Clinical Trials. Clin J Am Soc Nephrol. 2021; 16(8):1190-1200. doi:10.2215/CJN.16191020
- Barratt J, Dellanna F, Portoles J, Choukroun G, De Nicola L, Young J et al. Safety of Roxadustat Versus Erythropoiesis-Stimulating Agents in Patients with Anemia of Non-dialysis-Dependent or Incident-to-Dialysis Chronic Kidney Disease: Pooled Analysis of Four Phase 3 Studies. Adv Ther. 2023; 40(4):1546-1559. doi:10.1007/s12325-023-02433-0
- Sepah YJ, Nguyen QD, Yamaguchi Y, Otsuka T, Majikawa Y, Reusch M et al. Two Phase 3 Studies on Ophthalmologic Effects of Roxadustat Versus Darbepoetin. Kidney Int Rep. 2022; 7(4):763-775. Published 2022 Jan 19. doi:10.1016/j.ekir.2022.01.1045
- Li J, Haase VH, Hao CM. Updates on Hypoxia-Inducible Factor Prolyl Hydroxylase Inhibitors in the Treatment of Renal Anemia. Kidney Dis (Basel). 2022; 9(1):1-11. Published 2022 Oct 31. doi:10.1159/000527835
- Locatelli F, Del Vecchio L, Elliott S. The anaemia treatment journey of CKD patients: from epoetins to hypoxia-inducible factor-prolyl hydroxylase inhibitors. Clin Kidney J. 2023; 16(10):1563-1579. Published 2023 Aug 17. doi:10.1093/ckj/sfad105
Imlifidase : nouvel espoir d’accès à la greffe pour les patients hyperimmunisés en attente de transplantation rénale par rein de donneur décédé
Nada Kanaan, Thibaut Gervais, Antoine Buémi, Arnaud Devresse, Eric Goffin, Tom Darius, Yannick France, Michel Mourad, Véronique Deneys, Corentin Streel
Introduction
Pour les patients en insuffisance rénale terminale, la transplantation rénale est le traitement de choix. Le développement d’anticorps anti-HLA à la faveur d’évènements immunisants comme les grossesses, transfusions sanguines ou transplantations antérieures concerne près d’un tiers des patients inscrits sur la liste d’attente de transplantation par rein de donneur décédé. L’hyperimmunisation - définie comme un taux d’anticorps dirigés contre un panel d’antigènes de donneurs > 85% (Panel Reactive Antibodies PRA > 85%) - concerne environ 5-15% des patients sur la liste d’attente. Ces patients hyperimmunisés ont peu de chances de trouver un organe d’un donneur compatible, avec comme conséquences un temps d’attente pour être transplanté extrêmement long et, pour certains, une très faible chance d’être appelé à la greffe.
Jusqu’à récemment, les options pour augmenter les chances d’être transplanté étaient la donation vivante (directe ou croisée) ou l’intégration au programme « acceptable mismatch » (AM) d’Eurotransplant (programme qui permet de définir des antigènes HLA immunologiquement acceptables).
Imlifidase
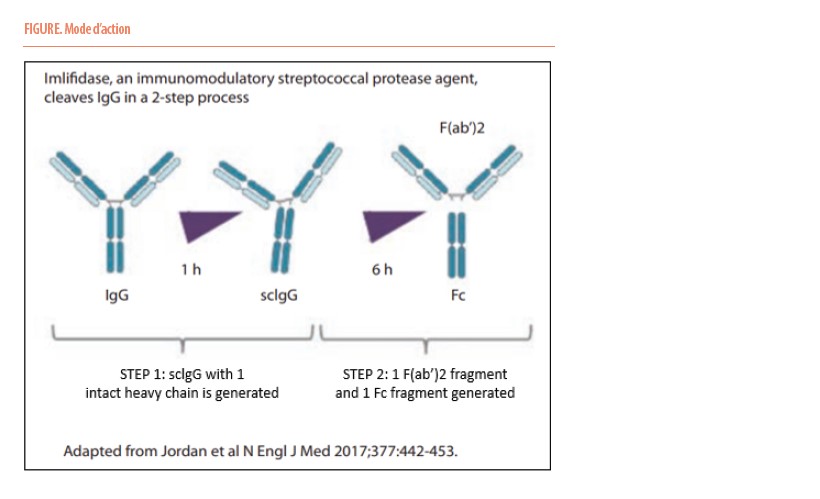
Imlifidase (IML) est une enzyme (cystéine protéase) dérivée du Streptococcus pyogène qui clive et dégrade de façon spécifique toutes les immunoglobulines IgG (figure). Quatre à six heures après l’infusion de l’imlifidase, le pool entier d’IgG est dégradé en Fragments F(ab’)2 et Fc inactivant ainsi la cytotoxicité dépendante du complément et la cytotoxicité cellulaire dépendant des anticorps. La production d’IgG de novo est détectée 2 à 3 jours après traitement par IML. La première étude publiée en 2017 dans le NEJM a rapporté l’efficacité du traitement par IML pour éliminer les anticorps IgG et permettre la transplantation HLA-incompatible chez 24 patients (1). Depuis lors, d’autres études ont confirmé ces résultats et les données à 3 ans post transplantation montrent une survie des patients de 90%, une survie des greffons de 84%, avec cependant une incidence de rejet humoral aigu de 38%.
En Belgique
Imlifidase (Idéfirix®) est remboursé en Belgique depuis le 1er juin 2023. Un protocole clinique national est implanté dans les centres de transplantation. Les patients éligibles sont identifiés sur base des critères repris dans le tableau. La stratégie du traitement implique de délister certains antigènes contre lesquels le patient a des anticorps, augmentant ses chances d’être appelé à la greffe (4-5).

Conclusion
Imlifidase offre une fenêtre d’opportunité à la transplantation pour les patients hyperimmunisés. La survie des greffons et des patients est satisfaisante avec un recul de 3 ans, malgré un risque de rejet humoral aigu élevé (1-5).
Références
Jordan SC, Lorant T, Choi J, Kjellman C, Winstedt L, Bengtsson M, et al. IgG Endopeptidase in Highly Sensitized Patients Undergoing Transplantation. N Engl J Med. 2017; 377(5):442–53. 10.1056/nejmoa1612567.
Jordan SC, Legendre C, Desai NM, et al. Imlifidase Desensitization in Crossmatch-positive, Highly Sensitized Kidney Transplant Recipients: Results of an International Phase 2 Trial (Highdes). Transplantation. 2021 Aug 1;105(8):1808-1817.
Kjellman C, Maldonado AQ, Sjöholm K, et al. Outcomes at 3 years posttransplant in imlifidase-desensitized kidney transplant patients. Am J Transplant. 2021 Dec;21(12):3907-3918.
Couzi L, Malvezzi P, Amrouche L, et al. Imlifidase for Kidney Transplantation of Highly Sensitized Patients With a Positive Crossmatch: The French Consensus Guidelines. Transpl Int. 2023 Jun 28;36:11244.
de Weerd AE, Roelen DL, van de Wetering J, Betjes MGH, Heidt S, Reinders MEJ. Imlifidase Desensitization in HLA-incompatible Kidney Transplantation: Finding the Sweet Spot. Transplantation. 2023 Jun 21; 108: 335-345.
Affiliations
Cliniques universitaires Saint-Luc
1. Service de Néphrologie
2. Biologie Hématologique
3. Transplantation rénale
Correspondance
Pr Eric Goffin
Cliniques universitaires Saint-Luc
Néphrologie
Avenue Hippocrate 10
B-1200 Bruxelles
eric.goffin@uclouvain.be
Conflits d’intérêt
Elliott Van Regemorter déclare avoir perçu des honoraires pour conférences sur le roxadustat de la part de la société Astellas.