Introduction
Le glycocalyx endothélial (GLX) est une structure complexe micro-fibrillaire située au pôle apical de la cellule endothéliale. Il constitue la barrière histologique entre la cellule et la lumière vasculaire et à bien des égards, se comporte comme un organe à part entière. Des travaux récents ont mis en évidence l’importance particulière de son implication dans la physiopathologie des patients souffrant de la COVID-19. Cette revue propose de résumer les données pertinentes pour le clinicien. Premièrement nous décrirons les éléments de structure du GLX ainsi que ses propriétés intéressantes dans notre prise en charge clinique. Après avoir cité les pathologies chroniques qui affectent le GLX, nous présenterons les modifications du GLX induites par la tempête inflammatoire caractéristique de la COVID-19. Enfin, nous mettrons en perspective les différents traitements connus qui nous permettent de prévenir sa destruction et d’en limiter les complications.
Quelle est la constitution du GLX endothélial ?
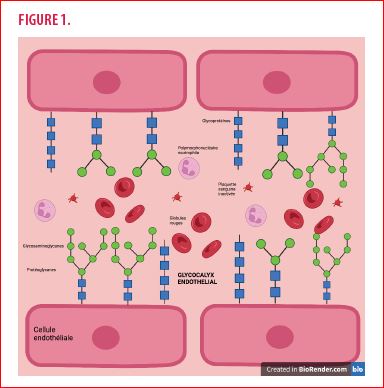
L’épaisseur du GLX varie entre 10 et 100 nanomètres. Le GLX est essentiellement composé des éléments suivants : les protéoglycanes, les glycosaminoglycanes, des glycoprotéines et d’éléments solubles plasmatiques (1).
Les protéoglycanes sont les constituants majeurs du GLX endothélial dont ils représentent la structure de base. De façon générale, ils sont constitués d’une chaine protéique centrale sur laquelle sont liées des chaînes de glycosaminoglycanes par l’intermédiaire de protéines de liaison. Ils sont rattachés à la membrane plasmique composée de phospholipides.
Les glycosaminoglycanes sont des macromolécules glucidiques qui s’attachent à une chaîne protéique pour former des protéoglycanes. Ils confèrent les propriétés du GLX. Les glycosaminoglycanes sont chargés négativement et contribuent à la rétention d’eau ainsi qu’à la fixation des protéines et composants solubles du plasma.
Les glycoprotéines peuvent être caractérisées en deux catégories. Les sélectines qui permettent de créer des interactions faibles et transitoires entre les cellules endothéliales et les leucocytes. Il s’agit de l’étape d’initiation du phénomène de diapédèse (2). Les intégrines sont les médiateurs de l’interaction cellulaire entre la cellule endothéliale et les plaquettes sanguines.
Ces composants possèdent des propriétés multiples dans les interactions et dans la rétention des éléments solubles plasmatiques avec la cellule endothéliale. Le GLX est donc en première ligne dans la transmission d’informations entre la lumière vasculaire, l’endothélium et l’espace extravasculaire.
Quelles sont les propriétés du GLX participant à l’homéostasie de la barrière endothéliale ?
Le GLX joue un rôle dans le comportement cellulaire de l’endothélium. Il intervient dans le remodelage cellulaire induit par les contraintes de cisaillement. Tout fluide possédant une viscosité présente en son sein des contraintes de cisaillement lors de son écoulement. Lorsque les composants du GLX transmettent les forces de cisaillement aux fibres de stress du cytosquelette endothélial, les filaments d’actine qui le constitue modifient leur orientation pour favoriser la formation de cavéoles (3). Ces dernières ont une composition lipidique particulière. Il a été démontré que les synthases endothéliales de monoxyde d’azote (eNOS) sont surtout localisées au niveau des lipides du GLX. L’augmentation de la production des cavéoles en réponse aux contraintes de cisaillement induit une augmentation du recrutement et de l’activation des eNOS, ce qui induira une production de monoxyde d’azote, et donc une vasodilatation. Le monoxyde d’azote régule le tonus vasculaire et le débit sanguin, inhibe l’adhésion et l’agrégation plaquettaire et inhibe l’adhésion leucocytaire et l’inflammation vasculaire (4).
Le GLX joue un rôle dans l’hémostase au niveau de l’endothélium en se liant à de nombreux composants plasmatiques régulant l’hémostase. L’héparane sulfate a une conformation moléculaire similaire à l’héparine. Il permet par exemple d’activer l’antithrombine qui inhibe l’activité du facteur Xa et de la thrombine (5). D’autres protéines anticoagulantes comme l’inhibiteur du facteur tissulaire et la thrombomoduline sont solubilisés dans le GLX. On peut donc estimer que le GLX maintient une interface anticoagulante entre l’endothélium et le sang. Le GLX, par ses chaines d’héparane sulfate, limite aussi l’agrégation plaquettaire en liant le facteur de Von Willebrand, ce qui diminue son exposition aux plaquettes sanguines (6). Une destruction du GLX entraîne une diminution de la concentration d’inhibiteurs de la coagulation au contact de l’endothélium. Il apparaît un état pro-coagulant par activation exacerbée de la cascade de la coagulation au niveau local avec consommation des différents facteurs de la coagulation. Elle entraine donc un état de coagulation intravasculaire disséminée au niveau microcirculatoire et une coagulopathie de déficit en facteurs de coagulation au niveau macro-circulatoire. Le risque d’hémorragie est augmenté et la microcirculation au niveau périphérique compromise.
En quoi la COVID-19 perturbe l’homéostasie du GLX endothélial ?
La forte réaction inflammatoire induite par les virus SARS-CoV-2 provoque un dysfonctionnement endothélial et favorise de graves complications cardiovasculaires telles que la thrombose veineuse, l’arythmie, le dysfonctionnement du myocarde et insuffisances rénales aigües.
Une structure commune aux coronavirus est la protéine Spike (S). Elle est composée d’une glycoprotéine d’enveloppe (membrane externe) qui facilite l’entrée du virus dans les cellules hôtes. Ce domaine se lie aux récepteurs de l’enzyme de conversion de l’angiotensine 2 (ACE2) qui les composent. Le SARS-CoV-2 a une forte affinité pour les cellules endothéliales riches de ces récepteurs (7).
Le composant héparane sulfate du GLX a une charge négative globale et peut donc interagir électrostatiquement avec les protéines S virales en se liant à son domaine chargé positivement. Le GLX sain limite donc le contact direct de la protéine S et des récepteurs membranaires ACE2 qui sont directement ancrés à la surface de la cellule endothéliale. En effet, une étude in vitro a étayé cette hypothèse en montrant les conséquences de l’élimination de l’héparane sulfate du GLX endothélial par le traitement à l’héparinase. L’élimination a conduit à une réduction significative de la force d’adhésion totale. De plus, la quantité d’événements de rupture a augmenté, ce qui dénote une augmentation des interactions spécifiques avec le récepteur ACE2. Ceci est confirmé par la coloration fluorescente du HS et de l’ACE2, où on peut observer un effet de la réduction du GLX et une expression accrue des récepteurs ACE2 (8).
Une perte de GLX suite à la cascade cytokinique qui caractérise l’infection par SARS-CoV-2 peut apparaitre en réponse à la production de réactifs oxygénés et à la production de TNF-α ainsi que d’autres médiateurs inflammatoires. Les médiateurs inflammatoires induisent une destruction du GLX par une surexpression des métalloprotéinases matricielles (MMPs) et des héparinases par les cellules endothéliales. D’une part, les héparinases vont cliver les chaines d’héparane sulfate attachées aux protéoglycanes, favorisant leur solubilisation dans le plasma. D’autre part, les MMPs dégradent directement la liaison des protéoglycanes à la membrane de l’endothélium (9). L’adhésion leucocytaire facilitée par la destruction du GLX, va entretenir et accélérer le phénomène en favorisant la production de réactifs oxygénés et nitrogénés. La production d’espèces radiculaires d’oxygène (H2O2, hydroxyle, anion superoxide…) est habituelle dans le métabolisme aérobie. Cependant, la situation devient pathologique lorsque leur production dépasse les capacités de protection comme lorsque la NADPH oxydase, enzyme qui participe à la production d’espèces radiculaires oxygénés (ROS) par les cellules endothéliales ou les polymorphonucléaires neutrophiles, est stimulée par les cytokines. Une destruction du GLX va par ailleurs favoriser les interactions entre les leucocytes sanguins et les récepteurs endothéliaux. Cette interaction va augmenter la production de cytokines et aggraver la dégradation du GLX. On comprend donc bien l’effet de cascade qui découle de ces états pathologiques.
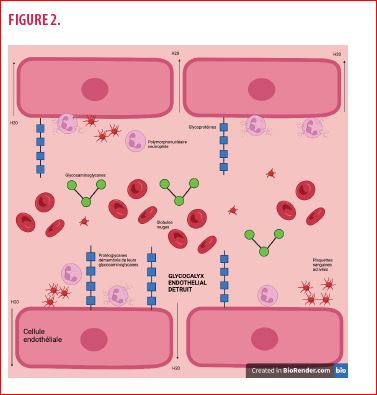
Quelle sont les conséquences cliniques de la dégradation du GLX dans la COVID-19 ?
Les fragments de glycosaminoglycanes tels que les Syndecan-1 ou l’acide hyaluronique, signature des lésions du GLX, sont présents et fortement associés aux scores d’évaluation de la défaillance séquentielle des organes et à l’augmentation des niveaux de cytokines inflammatoires chez les patients atteints du syndrome COVID-19 (10).
Au niveau pulmonaire, les cytokines inflammatoires ainsi que les espèces réactives oxygénées agressent le GLX et par la même occasion fragilisent l’espace alvéolo-capillaire. Cela se manifeste cliniquement par une hypoxie, une diminution du coefficient de diffusion des gaz respiratoires et peut être objectivé par des infiltrats pulmonaires à la radiographie. Au niveau rénal, cela va avoir pour effet la perturbation du débit sanguin par diminution de l’activité de la NO synthase et par hypercoaguabilité locale ainsi qu’une augmentation de la perméabilité vasculaire entrainant la création d’œdèmes. Il en résultera des nécroses tubulaires focales et une insuffisance rénale aigüe (11). Enfin au niveau cardio-vasculaire, cela se traduit par une multiplication des événements thombo-emboliques ainsi que des complications cardiaques (12,13).
Pourquoi certaines pathologies chroniques sont-elles des facteurs favorisant les formes graves de COVID-19 ?
Il existe une corrélation entre la dégradation du GLX et l’hypertension artérielle systémique chronique. Les leucocytes endothéliaux et circulants possèdent des récepteurs à l’angiotensine II de type 1 (14). La liaison de ces récepteurs leucocytaires par l’angiotensine II va favoriser la production de réactifs oxygénés (ROS) par les NADPH oxydases qu’elles contiennent. L’hypertension artérielle chronique va par ailleurs entraîner la création d’un cercle vicieux. En effet, elle va être à l’origine de la dégradation du GLX et favoriser les contraintes de cisaillement qu’il subit. Néanmoins, la capacité de ce dernier de répondre par une production de monoxyde d’azote sera aussi limité, entraînant une diminution de la capacité de l’endothélium de se dilater et donc d’entretenir l’état pathologique. Une méta-analyse a montré que les patients souffrant d’hypertension avaient un risque majoré de 2,5 de développer une forme sévère ou fatale de COVID-19 (15). Il n’y a par contre pas encore de consensus au sujet de l’utilisation d’inhibiteurs du système rénine-angiotensine pour améliorer le devenir du patient pour diminuer l’entrée du virus dans les cellules par les récepteurs ACE2.
Le diabète incontrôlé a des effets destructeurs au niveau des vaisseaux de petits calibres (extrémités des membres, glomérules rénaux, rétine, etc.). L’étude CORONADO sur plus de 1300 patients a montré que les patients diabétiques avaient beaucoup plus de chances d’être intubés et de décéder du COVID-19 (16). L’hyperglycémie a pour effet de dégrader la couche de GLX en scindant différents de ses constituants. L’origine de cette destruction n’est pas encore entièrement comprise mais elle favorise l’exposition des intégrines et sélectines sur lesquelles les leucocytes se lient et entraîner une augmentation de la production de ROS. La destruction du GLX va aussi favoriser l’expression des récepteurs ACE2. Le contrôle glycémique est donc important pour éviter de maintenir une production excessive de réactifs oxygénés et perpétuer la réaction inflammatoire au niveau endothélial.
Il n’existe pas pour le moment d’étude comparative entre la spécificité de l’infection par la COVID 19 et d’autres maladies inflammatoires telles que le sepsis, le patient polytraumatisé ou d’autres maladies thrombotiques systémiques sur l’intégrité du GLX. Une caractéristique de la COVID-19 est que la cascade inflammatoire ainsi que les prédispositions individuelles du patient induisent une majoration de la concentration des récepteurs ACE2 sur lesquels se fixe la protéine Spike du SARS-CoV-2. Cela pourrait être une raison de la forte proportion de formes graves et complications de la maladie chez les patients qui présentent des facteurs de risque endothéliaux (hypertension, diabète et autres antécédents cardio-vasculaires). Ces populations ont une expression personnelle importante de récepteurs ACE2 et l’effet de cascade induite par l’état très inflammatoire caractéristique de l’infection à SARS-CoV-2 en font des populations vulnérables.
On peut par contre évaluer la sévérité de l’infection sur l’intégrité du GLX par le dosage de marqueurs sanguins spécifiques, de la même manière que pour les autres états inflammatoires(10). Une concentration sérique importante de Syndecan-1 chez les patients malades de la COVID-19 est d’ailleurs corrélée à une mortalité plus élevée chez les patients admis en soins intensifs (17). Les marqueurs biologiques peuvent donc être un outil intéressant dans la prise en charge du patient, notamment dans le pronostic d’évolution clinique chez les patients hospitalisés.
Quelle a été l’évolution des traitements depuis le début de la pandémie ?
En plus d’une meilleure utilisation de l’oxygénothérapie non-invasive dans la prise en charge des patients atteints du SARS-CoV-2, deux traitements médicamenteux sont maintenant utilisés massivement pour améliorer la mortalité et morbidité des patients en diminuant la tempête cytokinique d’une part et pour prévenir les complications thrombo-emboliques d’autre part. Il s’agit des anti-inflammatoires stéroïdiens et de l’anticoagulation.
Les glucocorticoïdes réduisent certains aspects de la fonction immunitaire, comme l’inflammation. Ils atténuent la dégradation du GLX en supprimant la libération de cytokines et de chimiokines et en réduisant la migration des cellules inflammatoires et la dégranulation des leucocytes. L’essai RECOVERY fournit des preuves que le traitement par dexaméthasone à la dose de 6 mg une fois par jour pendant un maximum de 10 jours réduit la mortalité à 28 jours chez les patients atteints de COVID-19 qui reçoivent une assistance respiratoire. On recommande actuellement l’utilisation de la dexamethasone à partir du début de la tempête inflammatoire (18). Par contre, il n’existe pas encore d’étude étayant l’intérêt de la prescription des corticoïdes pour des patients en ambulatoire, notamment chez ceux qui présentent des facteurs de risque endothéliaux.
Les propriétés anti-inflammatoires précises des héparines non fractionnées et de faible poids moléculaire n’ont pas été établies. Le rôle de l’héparine dans le roulement, l’adhésion et la transmigration des globules blancs à travers l’endothélium est aussi encore à définir.
Par ailleurs, les héparines de faible poids moléculaire diminuent le risque d’événement thrombo-embolique. L’initiation précoce d’une anticoagulation prophylactique comparée à l’absence d’anticoagulation chez les patients admis à l’hôpital avec un COVID-19 a entre-autres été associée à une diminution du risque de mortalité à 30 jours et à aucune augmentation du risque d’événements hémorragiques graves (19). L’anticoagulation prophylactique peut aussi présenter un intérêt pour la prise en charge ambulatoire. Une étude a pu montrer une réduction du risque d’hospitalisation si on prescrit une anticoagulation prophylactique aux patients (20). Cela devrait être encore plus intéressant pour les patients qui présentent des facteurs de risques endothéliaux. L’opportunité de traiter un patient par anticoagulation à dose thérapeutique, même sans événement thrombo-embolique objectivé, est encore discutée dans la littérature.
Conclusion
Le GLX endothélial est une structure micro-fibrillaire polysaccharidique recouvrant la surface externe de la membrane cellulaire. Sa composition et ses propriétés physiologiques ont une importance dans la compréhension du COVID-19. Il doit être considéré comme un organe à part entière. Cette pathologie a un effet particulièrement destructeur sur le GLX endothélial qu’il conviendra d’anticiper tout au long de la prise en charge d’un patient qui contracte la maladie. Les répercussions organiques du dysfonctionnement endothélial sont majeures. Une prise en charge et une surveillance médicale adaptée aux facteurs de risques endothéliaux du patient doit être privilégiée, notamment pour le traitement en ambulatoire ou lorsque des signes cliniques de gravité seraient encore absents. Enfin, deux traitements médicamenteux ont un effet bénéfique sur l’intégrité du GLX par la diminution de la réaction inflammatoire. Ils préviennent aussi les complications liées à sa destruction et ont été deux des remèdes les plus intéressants pour améliorer la mortalité et la morbidité du patient souffrant de la COVID-19 jusqu’à présent. La prise en charge clinique ainsi que la recherche pour l’utilisation de traitements novateurs pouvant améliorer l’intégrité du GLX doit être poursuivie.
Recommandations pratiques
- Faire un état des lieux des antécédents médicaux pouvant avoir un impact sur l’intégrité du glycocalyx endothélial d’un patient souffrant de la COVID-19.
- Adapter la prévention, le traitement, et anticiper les complications selon les facteurs de risque, aussi bien pour la prise en charge en ambulatoire qu’hospitalière.
Conflits d’intérêts
Les auteurs certifient qu’il n’y a aucun conflit d’intérêt avec une organisation financière concernant le sujet discuté dans le manuscrit.
Affiliations
1. Service d’Anesthésiologie, CHU UCL Namur (Godinne), Université Catholique de Louvain, Yvoir, Belgique
2. Service de chirurgie cardiovasculaire, thoracique et de transplantation pulmonaire, CHU UCL Namur (Godinne), Université Catholique de Louvain, Yvoir, Belgique
Correspondance
Docteur Alexandre Boulanger
Université Catholique de Louvain
CHU UCL Namur (Godinne)
Service d’Anesthésiologie
Avenue Dr Gaston Therasse 1
B-5530, Yvoir, Belgique
alexandre.b.boulanger@student.uclouvain.be
Références
- Alphonsus CS, Rodseth RN. The endothelial glycocalyx: a review of the vascular barrier. Anaesthesia. 2014 Jul; 69 (7):777–84.
- Dehghani T, Thai PN, Sodhi H, Ren L, Sirish P, Nader CE, et al. Selectin-targeting glycosaminoglycan-peptide conjugate limits neutrophil-mediated cardiac reperfusion injury. Cardiovasc Res. 2020 Oct 30;
- Lopez A, Panisello-Rosello A, Castro-Benitez C, Adam R. Glycocalyx Preservation and NO Production in Fatty Livers—The Protective Role of High Molecular Polyethylene Glycol in Cold Ischemia Injury. Int J Mol Sci. 2018 Aug 12;19 (8):2375.
- Forstermann U, Sessa WC. Nitric oxide synthases: regulation and function. Eur Heart J. 2012 Apr 1;33 (7):829–37.
- Dimitrievska S, Gui L, Weyers A, Lin T, Cai C, Wu W, et al. New Functional Tools for Antithrombogenic Activity Assessment of Live Surface Glycocalyx. Arterioscler Thromb Vasc Biol. 2016 Sep;36 (9):1847–53.
- Kalagara T, Moutsis T, Yang Y, Pappelbaum KI, Farken A, Cladder-Micus L, et al. The endothelial glycocalyx anchors von Willebrand factor fibers to the vascular endothelium. Blood Adv. 2018 Sep 25;2 (18):2347–57.
- Lan J, Ge J, Yu J, Shan S, Zhou H, Fan S, et al. Structure of the SARS-CoV-2 spike receptor-binding domain bound to the ACE2 receptor. Nature. 2020 May 14;581 (7807):215–20.
- Targosz-Korecka M, Kubisiak A, Kloska D, Kopacz A, Grochot-Przeczek A, Szymonski M. Endothelial glycocalyx shields the interaction of SARS-CoV-2 spike protein with ACE2 receptors. Sci Rep. 2021 Dec 9;11 (1):12157.
- Manon-Jensen T, Multhaupt HAB, Couchman JR. Mapping of matrix metalloproteinase cleavage sites on syndecan-1 and syndecan-4 ectodomains. FEBS J. 2013 May;280 (10):2320–31.
- Queisser KA, Mellema RA, Middleton EA, Portier I, Manne BK, Denorme F, et al. COVID-19 generates hyaluronan fragments that directly induce endothelial barrier dysfunction. JCI Insight. 2021 Sep 8;6 (17).
- Kunutsor SK, Laukkanen JA. Renal complications in COVID-19: a systematic review and meta-analysis. Ann Med. 2020 Oct 2;52 (7):345–53.
- Lambadiari V, Mitrakou A, Kountouri A, Thymis J, Katogiannis K, Korakas E, et al. Association of
COVID ‐19 with impaired endothelial glycocalyx, vascular function and myocardial deformation 4 months after infection. Eur J Heart Fail. 2021 Nov 13;23 (11):1916–26. - Al-Ani F, Chehade S, Lazo-Langner A. Thrombosis risk associated with COVID-19 infection. A scoping review. Thromb Res. 2020 Aug;192:152–60.
- Nagai M, Terao S, Vital SA, Rodrigues SF, Yilmaz G, Granger DN. Role of blood cell-associated angiotensin II type 1 receptors in the cerebral microvascular response to ischemic stroke during angiotensin-induced hypertension. Exp Transl Stroke Med. 2011 Dec 16;3 (1):15.
- Lippi G, Wong J, Henry BM. Hypertension and its severity or mortality in Coronavirus Disease 2019 (COVID-19): a pooled analysis. Polish Arch Intern Med. 2020 Mar 31;
- Cariou B, Hadjadj S, Wargny M, Pichelin M, Al-Salameh A, Allix I, et al. Phenotypic characteristics and prognosis of inpatients with COVID-19 and diabetes: the CORONADO study. Diabetologia. 2020 Aug 29;63 (8):1500–15.
- Zhang D, Li L, Chen Y, Ma J, Yang Y, Aodeng S, et al. Syndecan-1, an indicator of endothelial glycocalyx degradation, predicts outcome of patients admitted to an ICU with COVID-19. Mol Med. 2021 Dec 3;27 (1):151.
- Group RC HPLWEJMMBJLL. Dexamethasone in Hospitalized Patients with Covid-19. N Engl J Med. 2021 Feb 25;384 (8):693–704.
- Rentsch CT, Beckman JA, Tomlinson L, Gellad WF, Alcorn C, Kidwai-Khan F, et al. Early initiation of prophylactic anticoagulation for prevention of coronavirus disease 2019 mortality in patients admitted to hospital in the United States: cohort study. BMJ. 2021 Feb 11;n311.
- Hozayen SM, Zychowski D, Benson S, Lutsey PL, Haslbauer J, Tzankov A, et al. Outpatient and inpatient anticoagulation therapy and the risk for hospital admission and death among COVID-19 patients. EClinicalMedicine. 2021 Nov;41:101139.