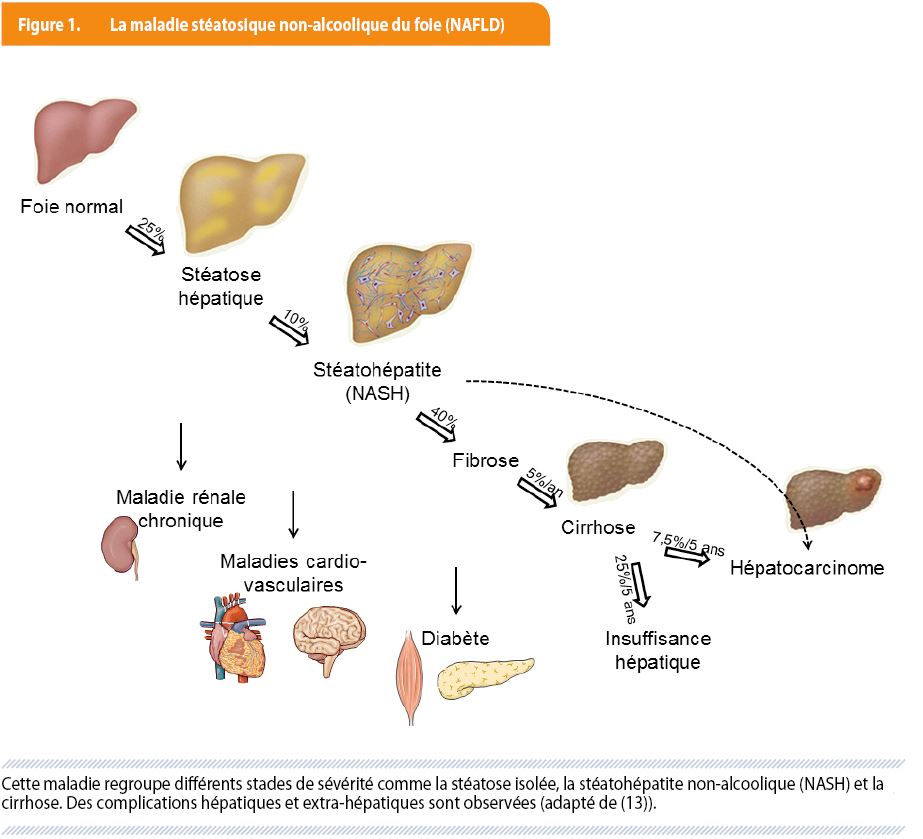
Longtemps considérée comme anodine, la stéatose hépatique devient l’objet de nombreuses recherches et mises au point chez les patients en raison de sa prévalence croissante (il s’agit désormais du premier motif de consultation pour mise au point de tests hépatiques perturbés et bientôt de la première indication de transplantation hépatique) y compris chez les enfants et adolescents, des complications qui sont mieux caractérisées (tant hépatiques que générales, figure 1) et des traitements en cours d’investigation.
Alors qu’une analyse histologique est théoriquement indispensable pour poser le diagnostic tant de stéatose que de stéatohépatite (forme inflammatoire plus agressive), de fibrose ou de cirrhose, de nombreux moyens non-invasifs sont actuellement à la disposition du clinicien pour suspecter la maladie et sa sévérité. Ils sont proposés dans un récent article de recommandation rédigé par des médecins belges de spécialités diverses (hépatologie, pathologie, radiologie, pédiatrie, cardiologie et endocrinologie) paru en 2018 (1).
Le but de cette présentation à l’occasion du congrès de l’Université catholique de Louvain de médecine générale est d’attirer l’attention sur cette pathologie qui, sans dépistage, ne serait suspectée qu’avec l’apparition de symptômes à des stades très avancés, alors qu’il existe désormais des moyens simples diagnostiques, préventifs et curatifs.
DÉFINITIONS
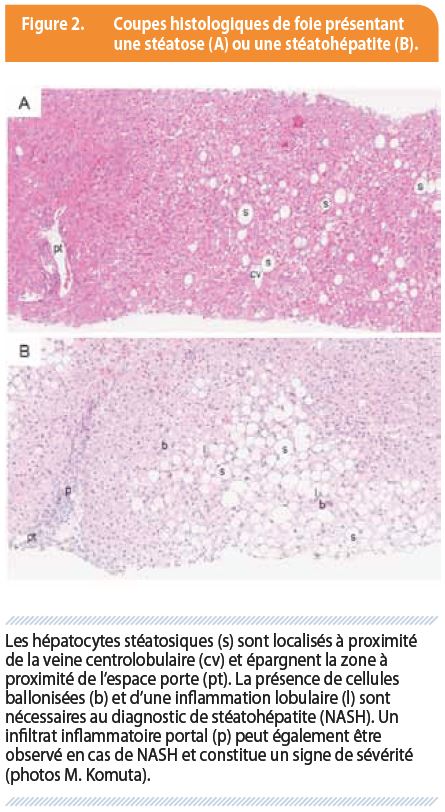
La stéatose hépatique est définie par un excès de graisse au sein des cellules du parenchyme hépatique (les hépatocytes), à savoir plus de 5 % du poids du foie ou plus de 5% des hépatocytes chargés de gouttelettes lipidiques à l’histologie (figure 2A).
Le terme « maladie stéatosique non-alcoolique du foie (NAFLD) » regroupe tous les stades de l’affection (figure 1) caractérisée par une stéatose hépatique qui ne doit pas être liée à la prise d’alcool. Cette stéatose peut être isolée ou accompagnée d’un infiltrat inflammatoire et/ou de dégâts hépatocytaires ainsi qu’éventuellement de fibrose ou de cirrhose. De manière plus restrictive que juste l’exclusion d’alcool, le terme NAFLD est habituellement réservé à la stéatose liée au syndrome métabolique, à l’obésité ou à une importante consommation calorique et n’inclut donc pas la stéatose secondaire à d’autres origines (tableau 1).

La stéatohépatite non-alcoolique (NASH) est une sous-entité de la NAFLD définie histologiquement par l’association de stéatose, d’un infiltrat inflammatoire dans le lobule hépatique et d’une souffrance hépatocytaire sous forme de cellules hépatocytaires ballonisées (figure 2B). Il est important d’établir la distinction entre la stéatose isolée et la NASH car l’évolution est différente, la NASH étant plus agressive.
FACTEURS DE RISQUE
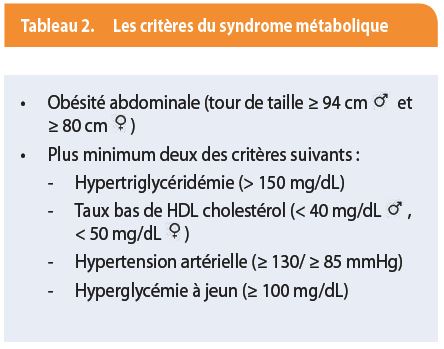
Plus que l’obésité, c’est la présence d’un syndrome métabolique (tableau 2) qui confère un risque de maladie stéatosique, en raison de l’adiposité androïde ou viscérale et de l’insulinorésistance. Une alimentation riche en sucre (sodas, pâtisseries, biscuits, …) et surtout en fructose (qui contrairement au glucose, est presque entièrement capturé par le foie et transformé en lipides plutôt qu’en glycogène) ou en graisse est également un facteur de risque, de même qu’un mode de vie sédentaire. Un dépistage de la NAFLD est donc recommandé chez les patients présentant un syndrome métabolique, une obésité (indice de masse corporelle ≥ 30 kg/m2), une élévation des tests hépatiques de cause inconnue, un diabète de type 2 ou un antécédent de maladie cardiovasculaire ischémique (cf. complications générales).
De nouveaux facteurs de risque sont également identifiés notamment génétiques (par exemple un polymorphisme génétique dans le gène de la protéine PNPLA3 impliquée dans la stéatose et la progression de la fibrose), épigénétiques, ethniques (patients hispaniques ou asiatiques) ou suspectés (défaut de capacité de stockage de graisse au niveau du tissu adipeux sous-cutané, obésité maternelle, sarcopénie, défaut d’activation du tissu adipeux brun, trouble du rythme circadien…).
COMPLICATIONS
HÉPATIQUES
La NAFLD est très répandue et touche environ 25 % de la population générale (et plus de 80 % de la population diabétique). Chez environ 10 % de ces patients, soit 2,5 à 5 % de la population adulte, la maladie évolue en une NASH. Parmi les patients NASH, environ 40 % vont développer une fibrose progressive, avec un risque de cirrhose de 5 % par an. Un haut degré d’inflammation portale joue un rôle particulièrement délétère dans le processus de fibrose (figure 2B) (2). Alors qu’il existe un risque faible d’hépatocarcinome (mal évalué) en cas de NASH sans cirrhose, ce risque d’hépatocarcinome est évalué à 7.5 % à 5 ans en cas de cirrhose sur NASH et celui de décompensation hépatique (ictère, ascite, encéphalopathie, hémorragie digestive variqueuse) à 25 % à 5 ans (figure 1). La présence d’un diabète ou d’une obésité associée à la maladie hépatique au stade de cirrhose augmente le risque d’hépatocarcinome ou de décompensation hépatique. Ces complications hépatiques sont donc liées à des NASH avec fibrose avancée (3).
NON-HÉPATIQUES OU GÉNÉRALES
La majorité des décès chez les patients présentant une NASH (même sans fibrose) est liée à des maladies cardio-vasculaires, la stéatose (et surtout la stéatohépatite) constituant un facteur indépendant de risque, au-delà des facteurs habituels. Une autre caractéristique de la stéatose est la résistance à l’insuline au niveau du foie induisant une production hépatique endogène de glucose non-contrôlée (4). Plusieurs études mettent également en évidence un lien entre la stéatose, l’inflammation du foie et l’apparition d’une insulinorésistance extra-hépatique (tissu adipeux et muscle) participant donc à l’apparition d’un diabète (5). Enfin, d’autres maladies sont étroitement liées à la présence d’une NAFLD comme le syndrome des apnées du sommeil, les cancers colorectaux, l’ostéoporose, les maladies rénales chroniques, le psoriasis ou le syndrome des ovaires polykystiques (figure 1) (6).
MOYENS DIAGNOSTIQUES
NON-INVASIFS
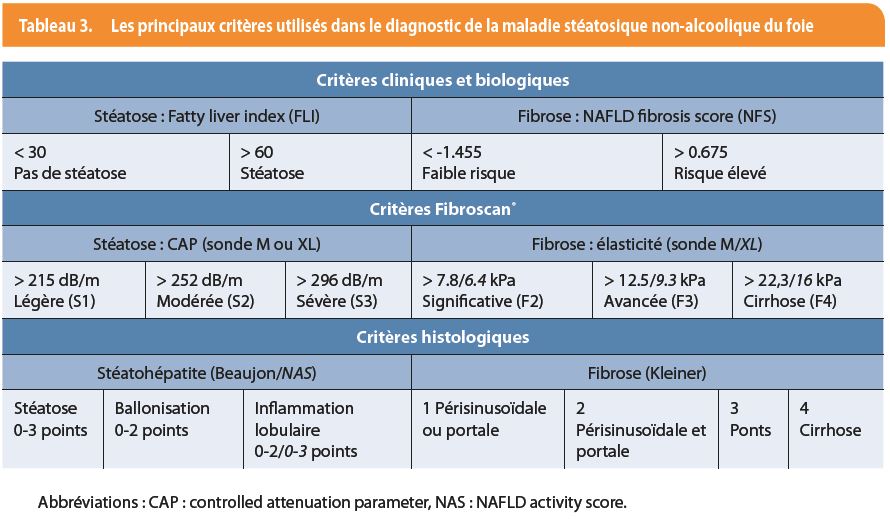
La stéatose peut être suspectée à l’imagerie en cas de présence de graisse dans le foie > 30 %. L’index de foie gras (Fatty Liver Index ou FLI) permet sur base de critères cliniques (indice de masse corporelle, périmètre abdominal) et biologiques (g GT, triglycérides) de conforter l’hypothèse d’une stéatose (tableau 3). La formule de calcul est disponible sur internet (www.mdapp.co). La mesure de l’atténuation de l’onde ultrasonore (Controlled Attenuation Parameter ou CAP) disponible sur le Fibroscan® permet quant à elle une estimation chiffrée de la quantité de graisse dans le foie, corrélée à l’analyse histologique (tableau 3) (7). La « Resonance Imaging Proteon Density Fat Fraction (MRI-PDFF) » procure une estimation encore plus fiable mais nécessite un examen de résonance magnétique.
Une quantification précise de la stéatose est toutefois peu importante étant donné le fait que les risques de la NASH résident principalement dans la présence d’inflammation. Malheureusement, à ce jour, il n’existe aucun moyen non-invasif satisfaisant permettant de suspecter la présence d’une NASH. En particulier, les transaminases sont peu corrélées à la sévérité de la maladie. Un taux normal de transaminases (même si idéalement les valeurs normales devraient être abaissées à 25 UI/L chez les femmes et 33 UI/L chez les hommes) n’exclut donc pas la présence d’une NASH.
L’estimation indirecte d’une fibrose peut être réalisée par de nombreux tests. Parmi eux, le score NAFLD de fibrose (NAFLD Fibrosis Score ou NFS) se basant sur l’âge, l’indice de masse corporelle, la présence d’un diabète et trois dosages biologiques de routine (transaminases, plaquettes, albumine) permet d’exclure une fibrose avancée en cas de résultat faible ou de l’affirmer en cas de résultawt haut (tableau 3). La formule est également disponible sur internet (www.nafldscore.com ou www.mdapp.co). De nombreuses techniques de mesure de l’élasticité du foie (élastométrie) ont été développées et sont plus fiables. La plus validée dans l’indication NAFLD-NASH est l’élastométrie impulsionnelle ultrasonore (Fibroscan®) qui étudie la propagation d’une onde de choc de faible amplitude à travers le parenchyme hépatique. Des critères de qualité de l’examen sont également proposés ainsi que des valeurs seuils pour chaque stade de fibrose, adaptées à la NAFLD et au type de sonde utilisé (tableau 3) (8). Cet examen permet donc une évaluation simultanée fiable de la stéatose et de la fibrose (9).
INVASIFS
La biopsie du foie donne un diagnostic de certitude quant à la maladie et sa sévérité (table 3). La stéatohépatite est évaluée selon le degré de stéatose, d’inflammation lobulaire et de ballonisation hépatocytaire (nécessité de minimum un point pour chaque item dans le score de Beaujon et d’un score de 5 pour le NAFLD activity score). Sa réalisation est donc habituellement réservée aux diagnostics incertains ou aux suspicions de maladies fibrosantes pour établir un score précis et permettre un suivi approprié ou l’inclusion du patient dans un protocole thérapeutique. Cette technique considérée comme la référence est toutefois imparfaite en raison de résultats parfois discordants entre plusieurs pathologistes observateurs et de son caractère invasif empêchant de nombreux examens de suivi chez un même patient. En cas de maladie sévère du foie, elle peut être réalisée par voie transveineuse (transjugulaire), associée à un risque hémorragique plus faible.
TRAITEMENTS
MESURES HYGIÉNO-DIÉTÉTIQUES ET CONTRÔLE DES FACTEURS DE RISQUE
La pierre angulaire du traitement est la restriction calorique couplée à une activité physique régulière visant une perte de poids > 5% du poids initial pour obtenir un effet sur la stéatose et l’inflammation et > 10 % pour un effet sur la fibrose. Ceci est difficile à obtenir chez les patients, surtout de manière durable (10). Un régime méditerranéen et une réduction de la consommation des hydrates de carbone semblent supérieurs aux autres types de régime. En l’absence de cirrhose, une consommation de boissons alcoolisées raisonnable (maximum 140 g/semaine) n’est pas déconseillée. Si indiqués, les traitements nécessaires pour le contrôle de la pression artérielle, de la dyslipidémie, de l’hyperglycémie ne doivent certainement pas être interrompus en cas de diagnostic de NASH mais doivent par contre être réévalués en cas de cirrhose décompensée.
TRAITEMENT CIBLÉ
Une forte dose quotidienne de vitamine E (800 unités) administrée pendant 2 ans chez des patients NASH sans diabète et sans cirrhose a été prouvée comme efficace sur la stéatose et l’inflammation mais pas sur la fibrose (11). D’autres études sont actuellement en cours avec des doses plus faibles. Ceci trouve tout son sens en raison de la toxicité suspectée de hautes doses de vitamine E. D’autres traitements comme le liraglutide et la pioglitazone ont montré une efficacité limitée et peuvent donc être utilisés s’ils sont indiqués pour d’autres raisons (diabète mal contrôlé, surpoids) mais aucun médicament disponible sur le marché n’a été approuvé par la Food and Drug Administration (FDA) ou l’Agence européenne des médicaments (EMA) dans l’indication NASH.
La chirurgie bariatrique est efficace pour diminuer la stéatose, l’inflammation et la fibrose. Elle n’a toutefois pas été étudiée dans cette indication, est associée à un risque opératoire et post-opératoire (avec certains cas de décompensation hépatique sur stéatose massive) et est formellement contre-indiquée en cas de cirrhose décompensée ou avec hypertension portale significative. Une évaluation correcte de la sévérité de la maladie du foie est donc conseillée avant la chirurgie éventuelle.
De nombreuses études pharmacologiques sont en cours et doivent être proposées aux patients en cas de NASH compliquée de fibrose en plus des mesures diététiques. Quatre molécules ont en effet prouvé un bénéfice sur l’histologie hépatique dans des études de phase 2 et sont actuellement testées en phase 3 (l’acide obéticholique, l’elafibranor, le cenicriviroc et le selonsertib). L’avenir du traitement médicamenteux résidera probablement dans l’association de plusieurs molécules ainsi que dans les preuves d’un bénéfice non-seulement sur l’histologie hépatique mais aussi sur la diminution du taux de complications et de décès (12).
TRANSPLANTATION HÉPATIQUE
Les indications de transplantation sont les mêmes que pour les autres maladies chroniques du foie (maladie sévère avec score de MELD > 15 points ou hépatocarcinome). La difficulté de la gestion de la transplantation dans cette indication est liée aux complications fréquentes cardiovasculaires, à l’obésité et à l’éventuelle récidive de la maladie post-greffe.
SUIVI
Un suivi des patients est nécessaire dès le diagnostic posé, avec le choix du traitement approprié. Une information concernant les complications hépatiques et générales doit être donnée. Pour les cas où aucune fibrose n’est suspectée, une nouvelle évaluation non-invasive de la fibrose est souhaitable au minimum après deux ans. En cas de fibrose avancée/cirrhose, un dépistage de l’hépatocarcinome par échographie est recommandé tous les six mois.
CORRESPONDANCE
Pr. Nicolas LANTHIER, MD, PhD
Cliniques universitaires Saint-Luc
Service d'Hépato-gastroentérologie
Avenue Hippocrate 10
B-1200 Bruxelles, Belgique
Université catholique de Louvain
Laboratory of Gastroenterology and Hepatology
Institut de Recherche Expérimentale et Clinique
RÉFÉRENCES
- Francque S, Lanthier N, Verbeke L, Reynaert H, van Steenkiste C, Vonghia L, et al. The Belgian Association for Study of the Liver guidance document on the management of Non-Alcoholic Fatty Liver Disease. Acta Gastroenterol Belg. 2018 February;81(1):55-81.
ouvrir dans Pubmed - Gadd VL, Skoien R, Powell EE, Fagan KJ, Winterford C, Horsfall L, et al. The portal inflammatory infiltrate and ductular reaction in human nonalcoholic fatty liver disease. Hepatology. 2014 April;59(4):1393-405.
ouvrir dans Pubmed - Dulai PS, Singh S, Patel J, Soni M, Prokop LJ, Younossi Z, et al. Increased risk of mortality by fibrosis stage in nonalcoholic fatty liver disease: Systematic review and meta-analysis. Hepatology. 2017 May;65(5):1557-65.
ouvrir dans Pubmed - Seppala-Lindroos A, Vehkavaara S, Hakkinen AM, Goto T, Westerbacka J, Sovijarvi A, et al. Fat accumulation in the liver is associated with defects in insulin suppression of glucose production and serum free fatty acids independent of obesity in normal men. J Clin Endocrinol Metab. 2002 July;87(7):3023-8.
ouvrir dans Pubmed - Lanthier N. The role of the liver in insulin resistance. Treatment Strategies - Hepatology. 2014;1(1):89-95.
- Adams LA, Anstee QM, Tilg H, Targher G. Non-alcoholic fatty liver disease and its relationship with cardiovascular disease and other extrahepatic diseases. Gut. 2017 June;66(6):1138-53.
ouvrir dans Pubmed - de Ledinghen V, Vergniol J, Foucher J, Merrouche W, Le Bail B. Non-invasive diagnosis of liver steatosis using controlled attenuation parameter (CAP) and transient elastography. Liver Int. 2012 July;32(6):911-8.
ouvrir dans Pubmed - Myers RP, Pomier-Layrargues G, Kirsch R, Pollett A, Duarte-Rojo A, Wong D, et al. Feasibility and diagnostic performance of the FibroScan XL probe for liver stiffness measurement in overweight and obese patients. Hepatology. 2012 January;55(1):199-208.
ouvrir dans Pubmed - Vuppalanchi R, Siddiqui MS, Van Natta ML, Hallinan E, Brandman D, Kowdley K, et al. Performance characteristics of vibration-controlled transient elastography for evaluation of nonalcoholic fatty liver disease. Hepatology. 2018 January;67(1):134-44.
ouvrir dans Pubmed - Vilar-Gomez E, Martinez-Perez Y, Calzadilla-Bertot L, Torres-Gonzalez A, Gra-Oramas B, Gonzalez-Fabian L, et al. Weight Loss via Lifestyle Modification Significantly Reduces Features of Nonalcoholic Steatohepatitis. Gastroenterology. 2015 April;149(2):367-78.
ouvrir dans Pubmed - Sanyal AJ, Chalasani N, Kowdley KV, McCullough A, Diehl AM, Bass NM, et al. Pioglitazone, vitamin E, or placebo for nonalcoholic steatohepatitis. N Engl J Med. 2010 May 6;362(18):1675-85.
ouvrir dans Pubmed - Townsend SA, Newsome PN. Review article: new treatments in non-alcoholic fatty liver disease. Aliment Pharmacol Ther. 2017 September;46(5):494-507.
ouvrir dans Pubmed - Cohen JC, Horton JD, Hobbs HH. Human fatty liver disease: old questions and new insights. Science. 2011 June 24;332(6037):1519-23.
ouvrir dans Pubmed