Évaluation fonctionnelle en chirurgie de la main
Xavier Libouton, Olivier Barbier
Mesurer la qualité des soins est un prérequis pour définir les actions à mettre en œuvre pour améliorer le service rendu aux patients. Dans ce but, l’appréciation objective et fiable des résultats d’une prise en charge chirurgicale est devenue incontournable. À côté des scores cliniques habituels réalisés par le praticien, il est important d’estimer également le retentissement d’une pathologie lors de la réalisation d’activités de la vie courante (évaluation fonctionnelle) et ses répercussions sur la qualité de vie du sujet, notamment après intervention chirurgicale.
Le choix d’une échelle parmi le large panel existant passe par la recherche de bonnes qualités métrologiques (reproductibilité, sensibilité au changement, validité de contenu, de construit, etc.) et sa validation auprès de patients à la typologie et à la pathologie précises.
Trois types de mesure évaluent la qualité des soins perçue par les patients avec des outils distincts :
1. Les Patient-Reported Outcome Measures (PROMs) pour le résultat des soins. C’est le résultat perçu par le patient.
2. Les Patient-Reported Experience Measures (PREMs) pour l’expérience des soins. Ce sont des instruments qui permettent de mesurer l’expérience perçue par le patient.
3. Les questionnaires de satisfaction des patients pour la réponse à leurs attentes.
En complément de l’évaluation des soins, il faut aussi tenir compte des situations relatives au fonctionnement humain et aux restrictions qu’il peut subir. C’est ce que la CIF (Classification Internationale du Fonctionnement) (1) permet de décrire. Pour rappel, la CIF envisage le fonctionnement du point de vue du corps, de la personne et de la personne en tant qu’être social.
Se basant sur la CIF et en ne perdant pas de vue l’évaluation de la qualité de soins, nous avons développé au sein de l’unité de chirurgie de la main un outil de mesures qui essaye de combiner ces différents paramètres. L’écueil principal rencontré dans l’élaboration du projet est comme souvent la distance entre la théorie et la réalité du terrain. En effet lors d’une consultation chirurgicale classique, le temps imparti est bien souvent restreint. Cela limite fortement les possibilités d’ajouter le remplissage de questionnaires ou d’autres moyens d’évaluation. Cependant, la technologie peut nous aider dans cette démarche essentielle. En collaboration avec le service informatique de notre institution, nous développons un outil qui permet au patient en salle d’attente de remplir différents questionnaires d’évaluation. L’interface patient est une tablette comme illustré sur la figure 1.

Actuellement, lors de sa première consultation, le patient en salle d’attente est invité à remplir :
1. Une échelle visuelle analogique de la douleur
2. Un questionnaire HABILHAND (2) (évaluation des répercussions de la pathologie perçue par le patient)
3. Un Quick-DASH (3) (idem)
4. UN SF-12 (évaluation des répercussions de la pathologie perçue par le patient en tant qu’être social)
L’ensemble des résultats dument complété est directement envoyé dans le dossier médical du patient. Dès que le patient rentre dans la cabine de consultation, nous disposons immédiatement de l’état de la situation pathologique dans laquelle se trouve le patient lorsqu’il s’adresse à nous.
A ce stade, nous n’en sommes qu’aux prémices du développement. L’étape suivante à implémenter sera de refaire une évaluation identique environ 6 mois après la consolidation du traitement qu’il ait été conservateur ou chirurgical.
Les possibilités de développement ultérieurs sont immenses surtout avec l’avènement de nouvelles technologies telle que l’intelligence artificielle qui n’ont surement pas fini de nous surprendre. Il n’est pas illusoire de penser que dans un avenir proche une caméra lidar (télédétection par laser) équipera les cabines de consultation révolutionnant la manière d’appréhender notre examen clinique mais cela est une autre histoire…
Références
- Rauch A, Cieza A, Stucki G. How to apply the International Classification of Functioning, Disability and Health (ICF) for rehabilitation management in clinical practice. Eur J Phys Rehabil Med. 2008 Sep;44(3):329-42.
- El Khoury G, Penta M, Barbier O. ABILHAND-HS: a linear scale for outcome measurement in hand surgery. J Hand Surg Eur. Vol. 2021 Feb 8:1753193421991485.
- Atroshi I, Gummesson C, Andersson B, Dahlgren E, Johansson A. The disabilities of the arm, shoulder and hand (DASH) outcome questionnaire: reliability and validity of the Swedish version evaluated in 176 patients. Acta Orthop Scand. 2000 Dec;71(6):613-8.
- Ware J Jr, Kosinski M, Keller SD. A 12-Item Short-Form Health Survey: construction of scales and preliminary tests of reliability and validity. Med Care. 1996 Mar;34(3):220-33.
Nouvelle approche dans les infections ostéoarticulaires : la phagothérapie ?
Randy Buzisa Mbuku, Hervé Poilvache, Maïte Van Cauter, Jean-Cyr Yombi, Olivier Cornu
La prise en charge des infections ostéoarticulaires reste une pathologie complexe qui, lorsqu’elle n’est pas prise en charge précocement est associée à une morbidité et une mortalité supérieure à beaucoup de cancers (1). Les stratégies mises en place avec des chirurgies répétées et l’utilisation d’antibiotiques de manière suboptimale conduisent à sélectionner des bactéries de plus en plus résistantes, rendant la prise en charge habituelle inopérante (2). Des stratégies innovantes recourant aux bactériophages sont actuellement considérées dans des cas où les options chirurgicales et médicales semblent compromises (3).
Les bactériophages sont des virus naturels qui ciblent des bactéries spécifiques. Il a été proposé de les utiliser pour traiter les infections bactériennes dans les années 1920, avant la découverte et l’utilisation généralisée des antibiotiques. Abandonnée dans nos contrées, la phagothérapie a été encore utilisée dans l’Est de l’Europe, particulièrement en Géorgie. La phagothérapie est un traitement prometteur pour les infections ostéoarticulaires car les phages ont la capacité de dégrader la matrice du biofilm et de lyser les bactéries (4). La faisabilité de la phagothérapie a été récemment démontrée, sur la base de plusieurs patients atteints d’infections osseuses et articulaires complexes et traités à titre compassionnel par phages (5-7).
Cependant, de nombreux aspects de cette thérapie sont mal compris, ce qui fait que les traitements manquent d’efficacité et de reproductibilité. Pour faire progresser cette thérapeutique, il convient de déterminer la sensibilité des bactéries aux phages, ou d’entrainer préalablement les phages à adresser différents clones de bactéries, sous peine que les variations phénotypiques des récepteurs d’attachement des membranes bactériennes, cibles des bactériophages, ou leurs interactions avec les macromolécules de nos organismes empêchent ces agents d’agir (8). La posologie et le mode d’administration doivent également être précisés. L’administration répétée des phages, localement au travers d’un cathéter laissé en place plusieurs jours est potentiellement associée à un risque accru d’infection par un germe non ciblé par les phages. L’administration par voie générale ou localement au décours du geste chirurgical, ou secondairement par ponction articulaire sous échographie paraissent actuellement plus prometteuses. Si la phagothérapie est à ce stade considérée comme une thérapie de sauvetage, combinée aux antibiotiques suppressifs et à une chirurgie de débridement à minima, des essais devraient être considérés pour enfin démontrer dans quels contextes cliniques elle pourrait offrir une réelle nouvelle approche thérapeutique.
Références
- Rezapoor M, Parvizi J. Prevention of Periprosthetic Joint Infection. J Arthroplasty. 2015;30:902-7. doi: 10.1016/j.arth.2015.02.044.
- Karczewski D, Müllner M, Hipfl C, Perka C, Müller M. Two-stage exchange for PJI with co-existing cerclages for fracture: higher rates of early re-infections and difficult to treat microbes. Arch Orthop Trauma Surg. 2022. doi: 10.1007/s00402-022-04361-0.
- Álvarez A, Fernández L, Gutiérrez D, Iglesias B, Rodríguez A, García P. Methicillin-Resistant Staphylococcus aureus in Hospitals: Latest Trends and Treatments Based on Bacteriophages. J Clin Microbiol. 2019;57:e01006-19. doi: 10.1128/JCM.01006-19.
- Totten KMC, Patel R. Phage Activity against Planktonic and Biofilm Staphylococcus aureus Periprosthetic Joint Infection Isolates. Antimicrob Agents Chemother. 2022;66(1):e0187921. doi: 10.1128/AAC.01879-21.
- Ferry T, Kolenda C, Briot T, Souche A, Lustig S, Josse J, et al., On Behalf Of The Lyon Bji Study Group, On Behalf Of The PHAGEinLYON Study Group. Past and Future of Phage Therapy and Phage-Derived Proteins in Patients with Bone and Joint Infection. Viruses. 2021;13:2414. doi: 10.3390/v13122414.
- Cano EJ, Caflisch KM, Bollyky PL, Van Belleghem JD, Patel R, Fackler J, et al. Phage Therapy for Limb-threatening Prosthetic Knee Klebsiella pneumoniae Infection: Case Report and In Vitro Characterization of Anti-biofilm Activity. Clin Infect Dis. 2021;73(1):e144-e151. doi: 10.1093/cid/ciaa705.
- Ferry T, Kolenda C, Batailler C, Gaillard R, Gustave CA, Lustig S, et al.; Lyon BJI Study group. Case Report: Arthroscopic “Debridement Antibiotics and Implant Retention” With Local Injection of Personalized Phage Therapy to Salvage a Relapsing Pseudomonas Aeruginosa Prosthetic Knee Infection. Front Med (Lausanne). 2021;8:569159. doi: 10.3389/fmed.2021.569159.
- Doub JB, Urish K, Chan B. Bacteriophage therapy for periprosthetic joint infections: Current limitations and research needed to advance this therapeutic. J Orthop Res. 2022. doi: 10.1002/jor.25432.
Avancées et perspectives dans le traitement des fractures non consolidées
Anaelle Mottet, Julie Manon, Robin Evrard, Karim Tribak, Dan Putineanu, Pierre-Louis Docquier, Thomas Schubert, Olivier Cornu
Malgré des soins attentifs, 5% des fractures secondaires à un traumatisme mineur et 20% de celles liées à un traumatisme de haute énergie ou associées à une ouverture du foyer de fracture ne consolideront pas et évolueront vers la pseudarthrose ou non consolidation. Le traitement de choix des retards de consolidation consiste en l’apport d’une greffe d’os autologue au site de fracture. Le mécanisme d’action de l’autogreffe est lié à la présence de cellules ostéoblastiques et de cellules stromales de la moelle, capables de se différencier vers la lignée ostéogénique, qui participent à la consolidation de la fracture. La consolidation, à la suite de cet apport d’os autologue, est obtenue dans 80% des cas. Malheureusement, ce prélèvement expose le patient à des complications aiguës au site de prélèvement (hématome, infection, fracture de l’aile iliaque, hernie colique, douleurs persistantes, …) et, en cas d’infection au site d’implantation, fait perdre au patient un matériel osseux précieux.
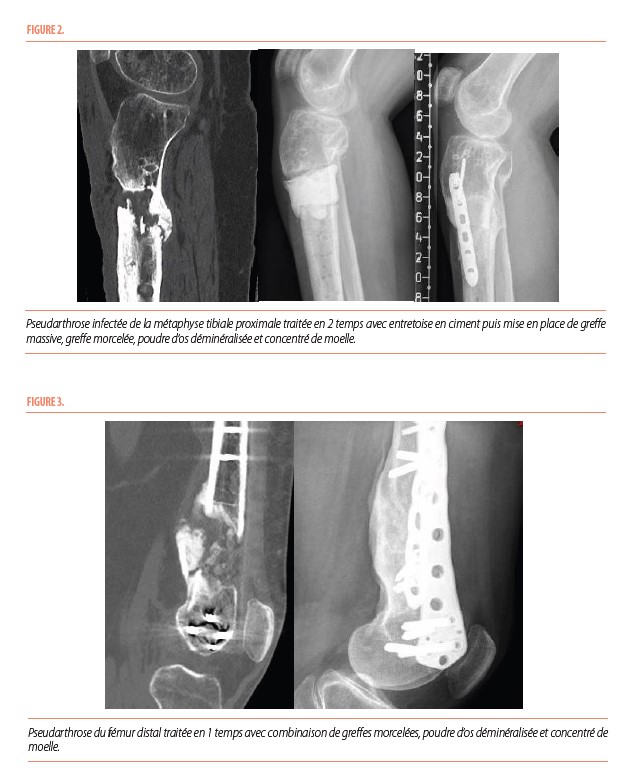
L’usage d’une aspiration de moelle osseuse pour la guérison des fractures a été envisagé avec des succès relatifs, limités par le nombre de cellules ostéoprogénitrices présentes dans la moelle (1-2). La possibilité de concentrer ces cellules par une simple centrifugation a remis cette approche à l’avant-plan dans le traitement des pseudarthroses avec des résultats similaires à l’autogreffe (3-5). Les cellules ostéoprogénitrices concentrées sont soit injectées au foyer de pseudarthrose de manière percutanée, éventuellement en association avec des protéines ostéoinductrices (facteurs de croissance de morphogenèse osseuse) obtenues à partir d’os déminéralisé ou implantées au décours d’une chirurgie (Figures 2 et 3), combinées à un apport d’allogreffes décellularisées servant de support ostéoconducteur et à des protéines inductrices pour favoriser la multiplication et la différenciation ostéogénique (6-8). Si ces approches thérapeutiques permettent d’égaler le traitement par une autogreffe, sans exposer le patient aux complications auxquelles celle-ci l’exposait, des recherches se poursuivent pour obtenir une consolidation osseuse dans un pourcentage encore plus élevé de cas ou dans des situations où la perte de continuité osseuse ne permet pas d’envisager la consolidation sans des reconstructions plus complexes. Une approche par greffe massive décellularisée et ensuite recellularisée par les cellules du receveur ou par une néo-ossification par une membrane périostée bio-ingéniérée sont actuellement en évaluation dans des modèles pré-cliniques (9-10).
Références
- Healey JH, Zimmerman PA, McDonnell JM, Lane JM. Percutaneous bone marrow grafting of delayed union and nonunion in cancer patients. Clin Orthop Relat Res. 1990;256:280-5.
- Delloye C, Cnockaert N, Cornu O. Bone substitutes in 2003: an overview. Acta Orthop Belg. 2003;69(1):1-8.
- Benshabat D, Factor S, Maman E, Khoury A, Krespi R, Ashkenazi I, Chechik, O, Dolkart O. Addition of Bone Marrow Aspirate Concentrate Resulted in High Rate of Healing and Good Functional Outcomes in the Treatment of Clavicle Fracture Nonunion: A Retrospective Case Series. J. Clin. Med. 2021; 10, 4749. https://doi.org/10.3390/jcm10204749
- Glenn R, Johns W, Walley K, Jackson JB, Gonzalez T. Topical Review: Bone Marrow Aspirate Concentrate and Its Clinical Use in Foot and Ankle Surgery. Foot & Ankle International. 2021;42:1205-1211. doi:10.1177/10711007211021017
- Modest JM, Lemme NJ, Testa EJ, Evans AR, Reid DBC. Successful Fracture Healing for Femoral Neck Nonunion with Bone Marrow Aspirate Concentrate. R I Med J. 2022;105:13-16.
- Cevolani L, Bianchi G, Costantino E, Staals E, Lucarelli E, Spazzoli B, et al. Minimally invasive treatment of long bone non-unions with bone marrow concentrate, demineralized bone matrix and platelet-rich fibrin in 38 patients. J Tissue Eng Regen Med. 2021;15:831-840. doi: 10.1002/term.3231.
- Nie W, Wang Z, Cao J, Wang W, Guo Y, Zhang C, Jia W, Li X. Preliminary outcomes of the combination of demineralized bone matrix and platelet Rich plasma in the treatment of long bone non-unions. BMC Musculoskelet Disord. 2021;22:951.doi: 10.1186/s12891-021-04840-2.
- Gómez-Barrena E, Padilla-Eguiluz N, Rosset P, Gebhard F, Hernigou P, Baldini N, et al. Early efficacy evaluation of mesenchymal stromal cells (MSC) combined to biomaterials to treat long bone non-unions. Injury. 2020;51 Suppl 1:S63-S73. doi: 10.1016/j.injury.2020.02.070.
- Heller U, Evrard R, Lengelé B, Schubert T, Kadlub N, Boisson J. Decellularized vascularized bone grafts as therapeutic solution for bone reconstruction: A mechanical evaluation. PLoS One. 2023;18(1):e0280193. doi: 10.1371/journal.pone.0280193. PMID: 36638107; PMCID: PMC9838862.
- Manon J, Evrard R, Fievé L, Bouzin C, Magnin D, Xhema D, et al. A New Osteogenic Membrane to Enhance Bone Healing: at the Crossroads between the Periosteum, the Induced Membrane, and the Diamond Concept. Bioengineering 2023, 10, 143. https://doi.org/10.3390/ bioengineering10020143.
Greffe osseuse autologue obtenue à partir de l’ingénierie tissulaire dans le traitement des pseudarthroses congénitales du tibia
Othmane Miri, Solange de Wouters, Pierre-Louis Docquier
Introduction
La pseudarthrose congénitale du tibia (PCT) est une pathologie rare de l’enfant dont l’incidence est de 1/150 000 naissances (1), elle est associée à la neurofibromatose de type 1 dans plus de 50% des cas (2).
Dans la PCT, le périoste est pathologique formant un hamartome fibreux, qui inhibe la vascularisation de l’os. L’os se déforme puis se fracture et la fracture ne consolide jamais (pseudarthrose). Quand la fracture est survenue, le traitement est chirurgical et représente un vrai challenge. En effet, c’est l’une des pathologies les plus difficiles à guérir en orthopédie et l’amputation n’est pas exclue après de multiples reprises chirurgicales. L’objectif de la chirurgie est de retirer le tissu pathologique, corriger la déformation et induire une consolidation osseuse. Plusieurs techniques chirurgicales ont été proposées, cependant aucune n’a montré un taux de succès satisfaisant (2).
Actuellement, aux Cliniques universitaires Saint Luc, nous testons un nouveau traitement qui s’avère très prometteur et dont les premiers résultats sont excellents.
Technique chirurgicale
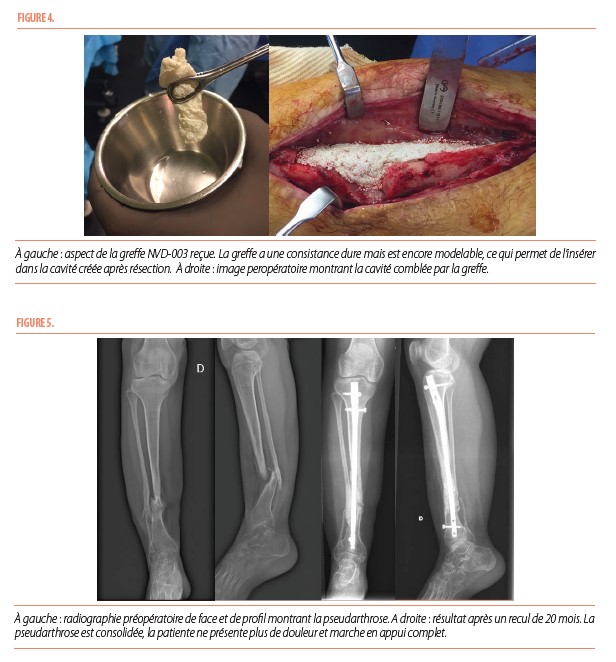
Cette technique repose sur une chirurgie en deux temps. Dans un premier temps, nous réalisons le prélèvement de tissu adipeux (lipo-aspiration) par une mini-incision au niveau de l’abdomen ou de la cuisse. De ce prélèvement, les cellules souches adipeuses sont isolées, cultivées et différenciées en ostéoblastes puis un implant 3D est créé en associant les cellules à de l’hydroxyapatite (NVD-003).
Dans un deuxième temps, 3 mois après la première chirurgie, nous procédons à la résection du tissu pathologique (hamartome fibreux) au niveau du tibia et de la fibula et l’espace laissé libre est comblé par la greffe autologue NVD-003 et une ostéosynthèse est réalisée par broches ou clou.
Les cas opérés à ce jour ont tous eu une consolidation complète sans aucune complication liée à l’utilisation du NVD-003.
Exemple clinique (Figures 4 et 5)
Jeune fille de 16 ans présentant une PCT qui avait déjà été opérée à de multiples reprises (incluant un enclouage flexible, une ostéosynthèse par plaque, un transport osseux par fixateur externe, deux tentatives de greffe osseuse autologue. Les deux dernières opérations s’étaient compliquées d’une infection à Staphylocoque doré. Elle devait porter une attelle en permanence pour stabiliser sa jambe. Une ostéosynthèse par clou centromédullaire a été réalisée avec implantation de 23ml de greffe osseuse NVD. Une consolidation a été obtenue et la patiente peut marcher en appui complet.
Références
- Pannier S. Congenital pseudarthrosis of the tibia. Orthop Traumatol Surg Res. 2011 Nov;97(7):750-61
- Paley D. Congenital pseudarthrosis of the tibia: biological and biomechanical considerations to achieve union and prevent refracture. J Child Orthop. 2019 Apr;13(2):120-33.
Affiliations
Service de Chirurgie Orthopédique et Traumatologie, Cliniques universitaires Saint-Luc UCL, Université catholique de Louvain, Bruxelles, Belgique.
*Contributeurs équivalents
Correspondance
Pr. Olivier Cornu
Cliniques universitaires Saint-Luc UCL
Service de Chirurgie Orthopédique et Traumatologie
Avenue Hippocrate 10
B-1200 Bruxelles