Il apparait, au cours de la période qui nous occupe, que l’urémie chronique a un retentissement extra-rénal. C’est le cas de l’hypertension artérielle, laquelle peut aussi, réciproquement, être la cause de l’urémie. L’invention du tensiomètre est, on le devine, la clé de ces observations.
Nous verrons ensuite que la notion d’insuffisance rénale aigüe (IRA) prend corps avec la description à Londres de la forme d’IRA déclenchée par l’écrasement musculaire atteignant les victimes du bombardement de la ville en 1941. L’IRA en général accèdera au statut d’entité diagnostique en 1951.
Ce sont cependant moins les cliniciens que les chercheurs qui vont défricher les terres nouvelles des connaissances médicales durant cette période ; après le règne de l’anatomie puis de la chimie, ils inaugurent une nouvelle science : la physiologie. Ils utilisent la méthode expérimentale chère à Claude Bernard. Ils montrent que, dans la remarquable homéostasie du milieu intérieur, le rein détient le rôle-titre, s’agissant tant de l’équilibre de l’eau que de celui des électrolytes. Ils formalisent le concept de clairance qui va devenir l’outil de référence incontournable de la mesure de la fonction rénale.
CLASSER LES NÉPHROPATHIES S’AVÈRE BIEN LABORIEUX
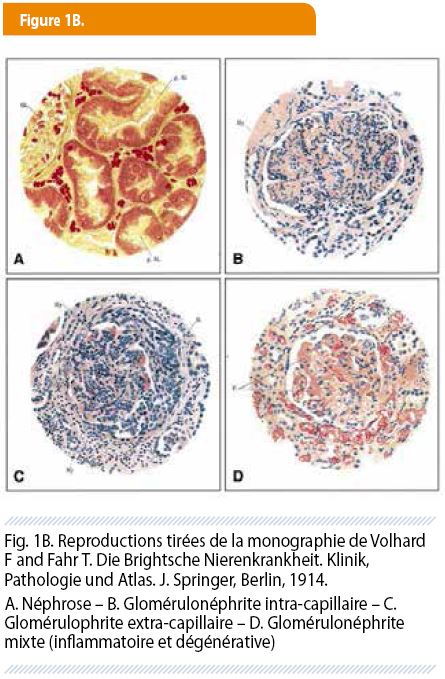
Les successeurs de Richard Bright font le constat d’abord de la réversibilité et de la récidive de certaines albuminuries, contrastant avec l’évolution irréversible de certaines autres, ensuite de l’existence de deux variétés macroscopiques de pathologies rénales : les « gros reins blancs » et les « petits reins indurés », une observation qui leur suggère que, sous le vocable « mal de Bright » se cachent au moins deux familles de maladie. Tel n’est pas l’avis de l’école allemande qui voit, dans ces variétés cliniques ou morphologiques, les stades évolutifs d’une entité unique (1,2). Les pathologistes allemands n’aident pas vraiment les cliniciens à y voir plus clair, puisque l’anomalie qui prévaut pour eux siège, tantôt dans l’interstitium, tantôt dans les cellules tubulaires (2)… Il faudra l’arrivée de nouvelles techniques de coupe et de coloration pour qu’Edwin Klebs (1834-1913) -dont la bactériologie se souvient par ailleurs avec l’espèce Klebsiella –attire enfin l’attention sur les lésions glomérulaires : il utilise, le premier, le terme de « glomérulonéphrite » dans son Traité de 1872 (2). Ce qui n’empêche pas les querelles nosologiques de reprendre à Berlin autour de 1900 avec le respecté Friedrich von Müller (1858-1941) : se fondant à nouveau sur les anomalies tubulo-interstitelles, il introduit le terme de « néphrose » pour décrire les lésions non inflammatoires des tubes qu’il considère comme « dégénératives », et il les oppose aux « néphrites » qui sont pour lui des maladies inflammatoires exsudatives. Cette classification est reprise et complétée en 1914 dans un traité qui devient rapidement le Nouveau Testament de la première moitié du XIXème siècle « Die Bright’sche Nierenkrankheit. Klinik, Pathologie und Atlas » rédigé par le binôme Franz Volhard (1872-1950) le clinicien, et Theodor Fahr (1877-1945) le pathologiste (figure 1A) ; ils y reproduisent avec beaucoup de talent les trois catégories qu’ils proposent : les néphroses (qui regroupent différentes maladies censées être d’origine dégénérative) ; les néphrites (qui comprennent des lésions focales ou diffuses et qui peuvent avoir un cours aigu ou chronique) ; les néphroscléroses (les lésions portent sur les artérioles ; l’évolution peut en être bénigne ou maligne) (figure 1B) (3). Nous reviendrons sur ces dernières dans la section suivante. Mais la plupart des autorités de l’époque, y compris Volhard et Fahr, continuent à penser que, dans les néphroses, la perte d’albumine est due à une sécrétion tubulaire…

Que fallait-il pour revenir à la vue plus glomérulocentrique prônée par E. Klebs ? D’abord, l’adhésion au concept du physiologiste Carl Ludwig (1816-1895) qui, comme nous verrons plus loin dans ce chapitre, démontrait l’existence d’une filtration de l’eau et des solutés plasmatiques au niveau du glomérule, suivie d’une résorption partielle du filtrat dans les tubules ; ensuite une démonstration expérimentale convaincante. Celle-ci fut l’œuvre d’un physiopathologiste bruxellois, Paul Govaerts (1889-1960) (4). Etudiant, avec ses collaborateurs férus d’anatomie comparée, la constitution des oedèmes dans diverses pathologies, il montre en 1924 (avec l’ingénieux osmomètre qu’il a conçu) que les oedèmes de la néphrose sont dus à l’abaissement de la pression oncotique du sérum, consécutif à une hypoalbuminémie, un mécanisme parfaitement en accord avec les lois élaborées par E.H. Starling dès 1896 (4, 5). Les techniques de microponction mises au point dans les années 60 confirmeront définitivement, chez l’homme, les observations de l’équipe de Govaerts.
A Stanford, l’Ecossais Thomas Addis (1881-1949) reprend à son tour la classification de Volhard et Fahr en la basant sur l’examen du sédiment urinaire (6).
Le terme générique de syndrome néphrotique n’apparaitra que dans les années 1930 et son démembrement attendra l’avènement de la biopsie rénale (voir 4ème partie).
L’IMMUNOPATHOLOGIE RÉNALE FAIT SES PREMIERS PAS
Comme son nom l’indique, l’immunopathologie désigne des maladies dont le mécanisme relève de processus immunologiques, c’est-à-dire ayant à voir avec la capacité de notre organisme à distinguer le soi du non-soi.
Alors que la notion d’immunologie en tant que système de protection physiologique remonte à l’Antiquité, l’idée que des maladies, en l’occurrence rénales, puissent être d’origine immunitaire, n’apparait qu’au XXème siècle avec la découverte de l’anaphylaxie, de l’allergie puis des maladies auto-immunitaires. Plantons le décor en en revoyant brièvement l’historique.
Les Romains avaient déjà remarqué que des personnes survivant à une épidémie de peste étaient protégées de l’épidémie suivante (ils bénéficiaient de « l’immunitas »). D’où l’idée, née en Chine semble-t-il, de s’exposer délibérément à une maladie (si possible une forme mineure…) afin de s’en trouver ultérieurement « immunisé ». D’où la pratique, en Angleterre, des premières « variolisations » (inoculation de vésicules de variole humaine afin d’être protégé de cette maladie), suivies de la première « vaccination » contre cette même variole (inoculation de vésicules de variole bovine ou vaccine) par A. Jenner, et enfin de la fameuse vaccination (ce terme étant devenu générique) contre la rage par L. Pasteur en 1855 (en utilisant de la moelle d’un lapin rabbique).
Trois découvertes s’échelonnant au cours du premier quart du XXème siècle vont faire la démonstration un peu inattendue du caractère parfois délétère de certaines réactions immunitaires (7). En tâchant d’immuniser des chiens contre des toxines urticantes, Charles Richet (le grand-père de Gabriel) fait une observation inattendue : certains chiens succombent quelques minutes après avoir reçu une deuxième dose, pourtant minime, de la toxine ; cette réaction d’hypersensibilité le surprend tellement qu’il la nomme « anaphylaxie » soit l’antipode de la prophylaxie. Ses travaux lui vaudront le Prix Nobel en 1913. Quelques années plus tard, Clemens von Pirquet (1874-1949), administre à des enfants du sérum de cheval immunisé contre des bactéries pathogènes. Il constate à son tour que certains réagissent violemment aux injections. Il déduit de ses observations qu’ils se sont sensibilisés contre le sérum de cheval, baptise ce phénomène « maladie sérique » et invente le terme « d’allergie » (allos = autre ; ergos = réaction). D’autres chercheurs trouveront plus tard que la maladie sérique est due à la formation de complexes antigènes – anticorps. Il revient enfin à Julius Donath (1870-1950) et Karl Landsteiner (1868-1943) d’identifier, dans le sérum de patients souffrant d’hémoglobinurie paroxystique nocturne, des hémolysines qui s’avèrent être des anticorps dirigés contre leurs propres globules rouges : c’est la première démonstration de l’existence de maladies auto-immunitaires.
C’est dans cette mouvance que l’immunopathologie rénale fait ses premiers pas. Grâce d’une part à l’observation attentive de patients souffrant de glomérulonéphrite aigüe, et d’autre part, aux enseignements tirés de divers modèles de glomérulonéphrites expérimentales. Dans la glomérulonéphrite post-streptococcique, Thomas Addis avait déjà fait remarquer qu’il s’écoule toujours une à trois semaines entre le début de la scarlatine et l’apparition des premiers signes d’atteinte glomérulaire, alors même que la streptococcie s’est dissipée mais qu’en revanche la réponse immune est à son acmé. D’autres observateurs ajoutent que la glomérulonéphrite ne survient qu’avec certaines souches de streptocoques (qui sont dès lors qualifiées de « néphritogènes »). Deux hypothèses sont avancées pour expliquer l’atteinte rénale : soit une réaction d’hypersensibilité à certaines protéines bactériennes, soit un processus auto-immunitaire dirigé contre des constituants glomérulaires altérés par les streptocoques.
Le modèle expérimental le plus étudié est la néphrite induite par un sérum néphrotoxique, dite de Masugi. Elle est produite, chez le rat, par l’injection du sérum d’un lapin qui a été immunisé contre un extrait de rein de rat. Deux générations de chercheurs s’attèlent à identifier le mécanisme de la phase aigüe puis chronique de cette glomérulonéphrite, avec des protocoles variés et des méthodes de plus en plus ciblées. Parmi celles-ci, le marquage des anticorps circulants par un radio-isotope ainsi que leur identification dans le tissu rénal grâce à l’immunofluorescence (voir 4ème partie) dans les années 1950 seront d’une très grande aide. Ces expériences mettront finalement sur la piste d’une variété rare (mais très intéressante sur le plan physiopathologique) de glomérulonéphrite : celle qui est due à des anticorps dirigés contre la membrane basale des glomérules. Le team emmené par Frank J. Dixon (1920-2008) à San Diego sera, dans ce domaine, le plus fécond. C’est lui qui élucide le mécanisme de la maladie sérique et, dans la foulée, reconnait la formation de complexes antigènes-anticorps comme étant la cause d’autres maladies demeurées jusque-là mystérieuses, telles que le lupus érythémateux et plusieurs variétés de glomérulonéphrites chroniques. Frank J. Dixon est à juste titre regardé par ses pairs comme le fondateur de l’immunopathologie rénale (7).
L’HYPERTENSION ARTÉRIELLE EST-ELLE LA CONSÉQUENCE OU LA CAUSE DE L’URÉMIE ?
A l’autopsie de certains patients albuminuriques, Richard Bright avait relevé l’existence d’une hypertrophie cardiaque. Il avait suggéré qu’elle résultait d’une « pression accrue dans la circulation, car le pouls de ses patients est souvent dur » (8, 9). Hypothèse hardie à une époque où il n’existe pas encore de tensiomètre ! Rendons-nous compte que jusqu’à la fin du XIXème siècle, les seuls moyens de deviner l’existence d’une hypertension artérielle sont en effet, outre la résistance à la compression de l’artère radiale, la constatation d’une cardiomégalie (percussion, position du choc de pointe) et l’observation, au fond d’œil (l’ophtalmoscope avait été inventé en Allemagne en 1860) d’une « rétinite albuminurique », entendez, une rétinopathie hypertensive.
Mais le mécanisme de l’hypertension reste obscur. Penchés sur leurs oculaires, les successeurs de Bright que sont William Gull (1816-1890) et Henry Sutton (1836-1891) sont frappés par l’existence, chez les urémiques ayant un petit rein granuleux d’une hypertrophie des parois artérielles, tant dans le rein que dans d’autres organes. Ce qui les conduit à avancer qu’une « fibrose artério-capillaire généralisée » explique, et l’hypertrophie cardiaque, et la maladie rénale (8).
Se fondant sur des modèles animaux, l’Allemand Ludwig Traube (1818-1876) développe une conception plus physiopathologique : pour lui « l’atrophie du parenchyme rénal… agit en réduisant la quantité de liquide… prélevée du système circulatoire par l’excrétion urinaire. Il en résulte que la pression artérielle doit s’élever », pressentant ainsi le rôle déterminant de l’hypervolémie dans la genèse de certaines hypertensions d’origine rénale (8,9). Une découverte expérimentale et une invention vont alors au tournant du siècle, éclairer d’un jour nouveau les liens unissant lésions rénales et hypertension.
En 1898, R. Tigerstedt montre que l’injection d’un extrait de rein de lapin induit chez d’autres lapins une élévation prolongée de la pression artérielle : il donne à ce principe actif, de nature inconnue, le nom de « rénine ». Ce n’est qu’en 1956 que sera identifiée la structure chimique de son substrat, « l’hypertensine » bientôt rebaptisée angiotensine (8,9).
Quant à l’invention qui conduit l’école de Bright à découvrir l’existence d’une hypertension dite « essentielle », c’est bien sûr celle du tensiomètre. Nous la devons au Bourguignon Etienne-Jules Marey (1830-1904), ingénieur né, contraint par son père à étudier la médecine. Avant lui, Jean Poiseuille (1799-1869) avait eu l’idée de mesurer directement la pression régnant dans le réseau artériel d’animaux d’expérience par un manomètre à mercure et d’autres physiologistes avaient ensuite tenté de la mesurer indirectement au niveau de l’artère radiale (9). E.J. Marey améliore leur dispositif : en mesurant l’amplitude et la durée des pulsations radiales ainsi que la compressibilité de cette artère, il conçoit le premier sphygmographe (fig. 2) en 1863. Le perfectionnement progressif de l’appareil, notamment par le Russe Nikolaï Korotkov (1874-1920) -qui ajoute en 1905 l’utilisation d’un stéthoscope sur l’artère brachiale- permet aux cliniciens de disposer, à l’aube du XXème siècle, de l’appareil que nous connaissons ainsi que des premières normes de pression artérielle.

Dès 1879, Frederik Mahomed (1849-1884) tire parti des premiers sphygmographes pour reprendre l’étude clinico-pathologique d’une série de « brightiques » suivis au Guy’s Hospital. Il fait une observation capitale :
« Il n’est pas rare de voir des personnes en bonne santé apparente, sans albumine dans les urines et sans aucun signe de maladie organique, dont la pression est constamment élevée au sphygmographe… L’hypertension est une condition circulatoire permanente chez quelques individus et cette anomalie appartient à une diathèse particulière. Je suis convaincu que les signes cliniques et anatomiques de l’hypertension artérielle existent souvent en dehors d’atteintes rénales discrètes quand elles ne sont pas complètement absentes ». (9).
Henry Huchard (1844-1910) à Paris, puis Franz Volhard (1872-1950) à Berlin confirment les données de Mahomed. F. Volhard fait des néphroscléroses, comme on l’a vu, une catégorie spécifique, qu’il subdivise en une forme bénigne et une autre maligne. Il suggère qu’une « élastose des artérioles » de prédisposition génétique et aggravée par l’âge engendre l’hypertension, dont le rein est une des victimes (9).
Ainsi donc, il devient clair, en un bon demi-siècle, qu’une néphropathie chronique conduit souvent à une hypertension artérielle et qu’à l’inverse, une hypertension « essentielle » (peut-être due à une maladie artériolaire) peut elle-même induire des lésions rénales. Bien plus tard, on découvrira que, chez des rats spontanément hypertendus, il existe en fait une anomalie de l’excrétion du sodium qui précède l’hypertension, le rôle du rein dans l’hypertension étant prouvé par la transplantation croisée de reins entre souches hypertendues et normo-tendues. Et on montrera enfin il y a peu, chez l’homme, la rémission de l’hypertension artérielle essentielle après binéphrectomie et transplantation d’un rein provenant d’un donneur normo-tendu (9), nous ramenant, en fin de compte, à l’idée que l’hypertension artérielle essentielle serait elle aussi d’origine rénale. Comme quoi, il ne faut jamais jurer de rien…
L’INSUFFISANCE RÉNALE CHRONIQUE EST PLUS QU’UNE MALADIE RÉNALE
Le terme d’insuffisance rénale chronique (IRC) n’apparait qu’aux alentours de 1950. Au fond, il ne fait que prendre la succession des « mal de Bright chronique », « urémie » et autres « azotémie »… Mais ce qui a beaucoup changé depuis un demi-siècle, c’est la disponibilité pour le clinicien, nous le verrons à la fin de ce chapitre, d’une mesure précise des taux sanguins d’urée, de créatinine et des électrolytes ainsi que d’une méthode de calcul de la clairance, la clairance de la créatinine devenant l’index de référence de la fonction rénale.
Dès la fin du XIXème siècle, il apparait que l’insuffisance rénale chronique entraine des complications extra-rénales, impliquant que le rein possède aussi une fonction endocrine. A côté de l’hypertension artérielle traitée plus haut, il s’agit du métabolisme phosphocalcique ainsi que de l’érythropoïèse.
Des cliniciens avaient été frappés par le rachitisme atteignant des enfants atteints d’IRC : y avait-il un lien entre IRC et métabolisme phosphocalcique ? En 1905, W.G. Mac Callum (1874-1944) décrit l’hyperplasie des glandes parathyroïdes associée à l’IRC. Trente ans plus tard, Fuller Albright (1900-1969) attribue cette hyperparathyroïdie à la rétention des phosphates allant de pair avec l’IRC. Ce n’est que dans les dernières décennies du siècle passé que l’on s’aperçoit que cette rétention entraine une hypocalcémie qui, à son tour, stimule la sécrétion de parathormone. Le schéma du mécanisme se complètera avec la mise en évidence du rôle du rein dans la synthèse de la vitamine D (10).
Quant à l’anémie associée à l’IRC, elle avait frappé les anciens qui avaient remarqué la pâleur des urémiques (10). L’érythropoïétine est découverte peu avant 1950. Vingt ans plus tard, la déficience de sa production par le rein en cas d’IRC, et ce, proportionnellement à la gravité de celle-ci, est clairement mise en évidence. La synthèse de l’érythropoïétine permet ensuite d’en faire le traitement parfaitement approprié de l’anémie associée à l’IRC que nous connaissons aujourd’hui (10).
L’INSUFFISANCE RÉNALE AIGÜE ACCÈDE AU STATUT D’ENTITÉ DIAGNOSTIQUE
Le diagnostic différentiel d’une insuffisance rénale aigüe (IRA) est, pour nos étudiants, un grand classique de l’examen de néphrologie. Leurs examinateurs savent-ils que ce terme ne remonte qu’à 1951 (11) ?
La description de l’IRA est évidemment bien plus ancienne. Qu’on se souvienne de l’expérience de Claude Galien (voir 1ère partie). Au XVIIIème siècle, William Heberden (1710-1801) -qui a par ailleurs laissé son nom aux nodosités des articulations des doigts accompagnant l’arthrose- en avait décrit une forme fatale et une forme réversible. Peu avant son contemporain Richard Bright, John Abercombie (1780-1828) en avait distingué l’origine supra-vésicale (vessie vide au cathétérisme) et infra-vésicale (vessie pleine) (12). En 1888, le pathologiste Francis Delafield (1841-1915) donne la description princeps de ce que nous appelons aujourd’hui la nécrose tubulaire aigüe (une des formes les plus fréquentes d’IRA, de cause toxique ou ischémique, parfaitement réversible après régénération des cellules nécrosées) :
« Les cellules tubulaires sont gonflées, leur contour devient irrégulier, elles sont infiltrées de granules et finissent par desquamer ; la lumière tubulaire se remplit de débris cellulaires, puis, de nouvelles cellules apparaissent pour remplacer l’épithélium qui a desquamé » (12).
Des descriptions de cas d’IRA de causes variées paraissent durant la première moitié du XXème siècle : la « néphrite de guerre » observée en 1917 à l’autopsie et « l’anurie fatale faisant suite à une transfusion sanguine » en sont deux exemples (12).
Le concept d’IRA prend véritablement corps en 1941 avec la publication demeurée célèbre de Bywaters dans le British Medical Journal, décrivant 4 cas d’IRA suite à un écrasement musculaire au cours du bombardement de Londres : la rhabdomyolyse (étymologiquement, « destruction de muscles rayés ») sera dès lors reconnue comme cause classique d’IRA par précipitation de la myoglobine dans les tubules rénaux.
Entretemps, comme nous le verrons, les physiologistes comprennent l’hémodynamique glomérulaire. Ils étudient l’effet des substances néphrotoxiques et observent la régénération tubulaire. L’un d’eux, Jean Oliver (1889-1976) publie, en 1951, dans le Journal of Clinical Investigation, l’acte de naissance circonstancié (132 pages !) de l’IRA en tant qu’entité clinique : « The pathogenesis of acute renal failure associated with traumatic and toxic injury. Renal ischemic nephrotoxic damage and the ischemuric episode » (11). Sur base de cet article, la même année, Homer Smith consacre le terme dans son fameux traité (13).
LA PHYSIOLOGIE RÉNALE SORT DES LIMBES ET ENFANTE DE LA PHYSIOPATHOLOGIE
Après l’anatomie puis la chimie, la nouvelle discipline qui domine le XIXème siècle s’appelle la physiologie. Son porte-drapeau dans notre domaine, Carl Ludwig, la définit comme la physique et la chimie des êtres vivants, la mission du physiologiste étant de traduire les processus complexes qui régissent le vivant en relations physico-chimiques (14). Le « vitalisme » est définitivement enterré. Replaçons-nous dans le contexte de l’époque.
La théorie de l’évolution avancée par Darwin et la parenté chimique de la composition des êtres vivants conduisent Claude Bernard à concevoir sa théorie du milieu intérieur, selon laquelle les ancêtres de l’homme n’avaient pu quitter l’océan qu’ « en le transportant avec eux » : nos cellules baignent en effet dans un liquide dont la composition chimique rappelle l’eau de mer (10) et son maintien dans des limites étroites est, pour Claude Bernard, « la condition d’une vie libre et indépendante ». C’est « sagesse du corps », poursuivra E.H. Starling en démontrant, quantitativement, la constance du milieu intérieur face aux variations tant de l’apport en eau ou en aliments que de l’environnement. En 1939, Walter Cannon synthétisera le concept en le nommant homéostasie (14). Il apparait alors que le rein y tient un rôle majeur. Homer Smith (1895-1962), le maitre à penser de nos prédécesseurs durant la première moitié du XXème siècle, proclamera dans « Le Poisson et le Philosophe » que le rein est le régulateur suprême du milieu intérieur (13). C’est l’aboutissement d’un siècle de recherche ayant mobilisé comme nous allons le voir les meilleurs médecins, pathologistes, chimistes et physiciens d’Europe et des Etats-Unis. Ils vont d’abord enfin comprendre le processus de formation de l’urine et découvrir ensuite les mécanismes assurant l’homéostasie de l’eau et des électrolytes.
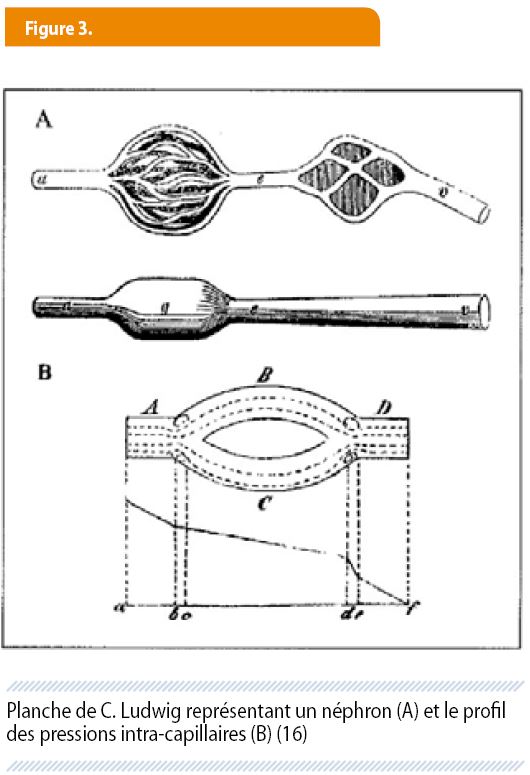
Il revient à l’Allemand Carl Ludwig d’avoir démontré, en 1842, que la production de l’urine commence par une filtration du sang à travers le glomérule. « D’abord, nous dit-il, je n’ai jamais observé de communication directe entre capillaire glomérulaire et lumière tubulaire ; ensuite je constate, en perfusant des reins ex vivo que le glomérule ne laisse passer ni protéines, ni graisse ». Il postule hardiment que c’est la pression intracapillaire qui doit forcer le passage du liquide plasmatique à travers la membrane glomérulaire, et ce, au prorata de son niveau ainsi que de la résistance de la membrane (figure 3). Il admet d’emblée que la filtration n’explique pas pour autant les modifications notables de composition de l’urine par rapport au plasma. « Il doit exister, poursuit-il, en aval du glomérule, des mouvements de l’eau et des électrolytes mettant en jeu des forces osmotiques » (15). Il a beaucoup de mal à faire accepter, y compris dans sa propre université, sa théorie de la filtration, car elle va à l’encontre de l’idée dominante à l’époque, nous l’avons vu, de la formation de l’urine par sécrétion tubulaire (16).
Représentant fameux d’une autre grande école de physiologie, celle de l’University College London, Ernest H. Starling (1866-1927) va, quelque 50 ans plus tard, cautionner et compléter le mécanisme de la filtration glomérulaire : prenant en compte la pression oncotique (c’est-à-dire la pression osmotique exercée par les protéines dans le plasma) il montre qu’il faut la soustraire de la pression hydraulique chère à C. Ludwig pour obtenir la pression nette d’ultrafiltration (17). Poursuivant les travaux du maitre, l’école de C. Ludwig termine le travail en démontrant à l’orée du XXème siècle, l’existence des 3 composantes intervenant dans l’élaboration de l’urine : filtration, réabsorption et sécrétion (16).
Pendant ce temps en France, c’est l’investigation clinique qui est privilégiée (1). Charles Achard (1860-1944) et Jules Castaigne (1871-1851) estiment qu’« il faut inventer des méthodes d’exploration physiologique permettant d’observer les organes en action, à l’état normal et pathologique ». C’est ainsi qu’ils montrent, en 1900, que, dans l’urémie, l’excrétion de bleu de méthylène, administré par voie sous-cutanée, est retardée (et ce, proportionnellement à la sévérité de l’urémie), alors qu’elle reste normale chez les patients oedémateux et albuminuriques, mais non urémiques.
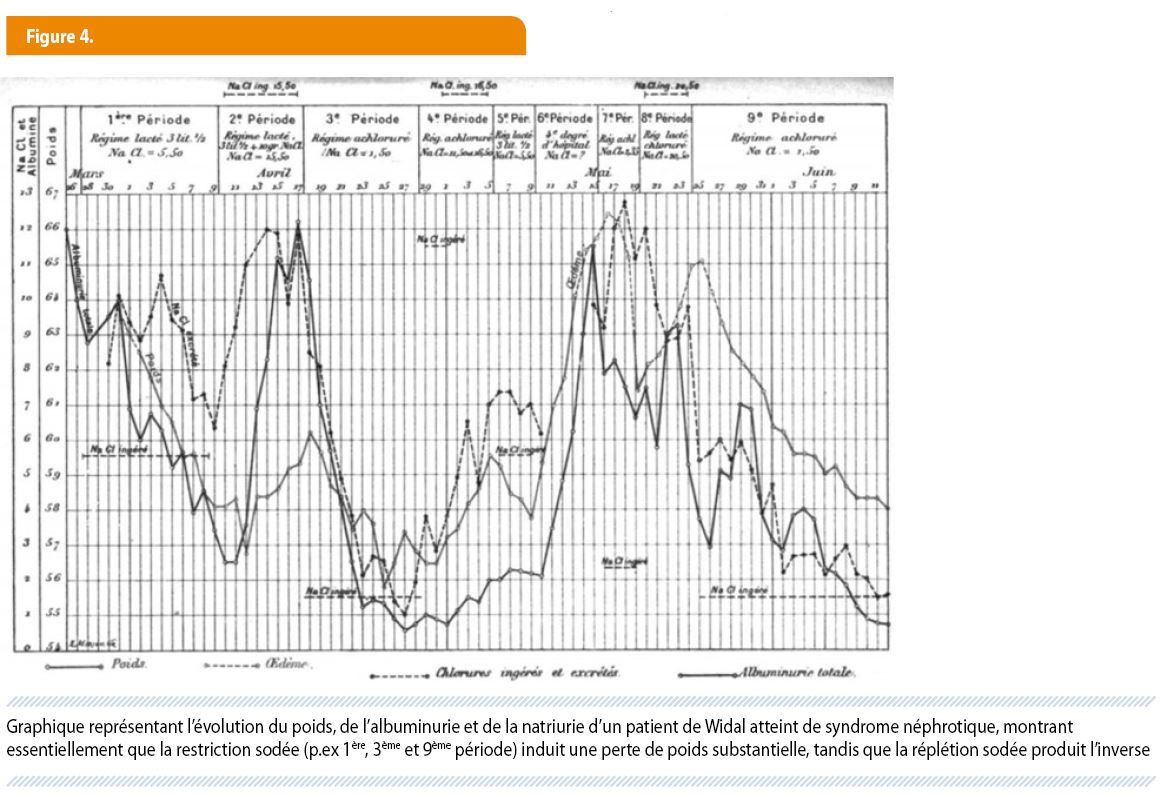
Au même moment, un clinicien berlinois, Hermann Strauss (1866-1944) fait une invention, paraissant presque triviale aujourd’hui, mais qui va ouvrir largement le champ de l’investigation au lit du malade : une aiguille creuse permettant d’obtenir, à loisir, des échantillons de sang veineux… Des études dites de bilan sont désormais possibles. Il suffit de quelques malades soigneusement étudiés pour répondre à une question physiopathologique. A Paris, Fernand Widal (1862-1929) est immédiatement un adepte de cette méthode. Quelques années après Achard et Castaigne, il montre que, dans la néphrite sévère sans œdème, il y a une rétention d’urée et que le poids ne se modifie pas avec l’apport en sel alors que, dans ce que nous appelons aujourd’hui le syndrome néphrotique, l’apport en sel induit, réversiblement, un gain de poids et une aggravation des oedèmes, sans modification concomitante du taux sanguin d’urée (fig 4). Il en déduit que « la rétention de ce sel dans certains tissus peut y attirer une partie de l’eau de l’organisme et provoquer un œdème », hypothèse qui sera confortée par d’autres, comme nous l’avons vu avec les expériences de P. Govaerts (1).
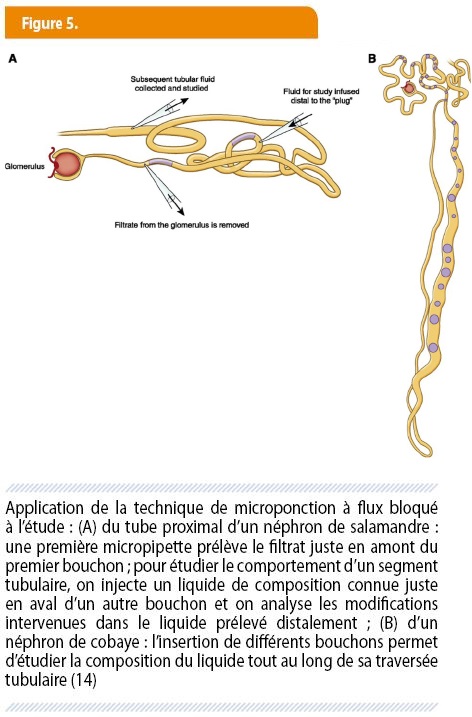
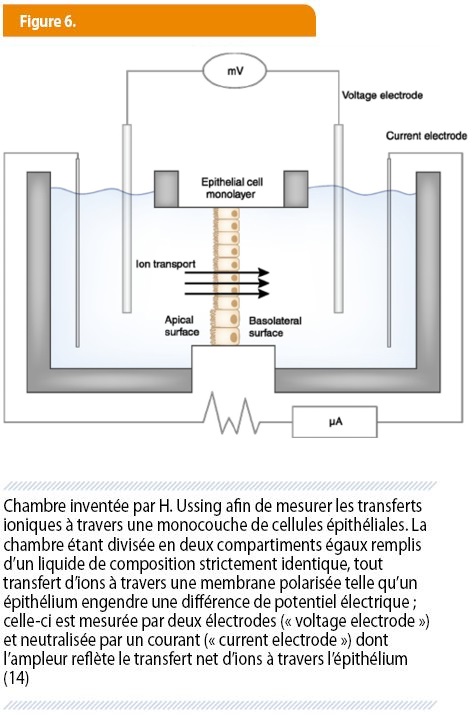
Outre-Atlantique, l’exploration méthodique du néphron se poursuit avec un succès remarquable, tenant autant à des avancées technologiques qu’à l’ingéniosité des protagonistes. Les méthodes de microponction du glomérule apportent, dans les années ‘30, une confirmation éclatante de la théorie de formation de l’urine avancée par Ludwig et les siens. La technique dite du flux bloqué (par insertion d’un bouchon d’huile) permet, dès 1930, d’étudier le comportement des cellules tubulaires, segment par segment (fig 5) (14). Cette technique n’informe cependant que sur les transferts intéressant le versant luminal (ou apical) de la cellule tubulaire. Pour étudier simultanément le comportement du versant opposé (basolatéral), l’astucieux zoologiste danois Hans Ussing (1911-2000) invente, dans les années 1950, la « chambre » qui porte désormais son nom (fig 6) (14). Le perfectionnement des techniques de microdissection et de biochimie culmine, en 1960, avec l’identification du premier transporteur tubulaire, la Na-K-ATPase (14). Comme nous le verrons dans la 4ème partie, l’explosion de la génétique va par la suite donner un coup d’accélérateur à la cartographie touffue des pompes et transporteurs du néphron. C’est pourtant avec les techniques prévalant avant 1960 que sont déjà comprises d’autres fonctions importantes du néphron : le maintien de l’équilibre acido-basique, l’homéostasie de l’eau et l’autorégulation conférée par l’appareil juxtaglomérulaire. Résumons-les.
La contribution du rein à l’« équilibre acide-base » (terme créé par le fameux Henderson, celui de l’équation dont il partage la paternité avec Hasselbach) doit beaucoup à deux physiologistes américains. L’un est Robert Pitts (1908-1977) : il est le premier à montrer que l’acidification de l’urine s’opère par la sécrétion tubulaire d’ions hydrogènes et il en explique la régulation (18). L’autre est James-Lawder Gamble (1883-1959). Il crée, chemin faisant, un des jouets favoris du néphrologue confronté à un désordre électrolytique : le Gamblegram, qui applique, graphiquement, la loi de neutralité électrique de toute solution en équilibre.
Elève de E Starling, Ernest Verney (1894-1967) découvre de son côté le rôle complémentaire des osmorécepteurs carotidiens et de l’hormone antidiurétique dans l’homéostasie de l’eau. Il écrit en 1947 (17) : « la libération de l’hormone antidiurétique est en permanence contrôlée par la concentration de NaCl qui baigne la carotide. La précision de cet ajustement est remarquable, puisqu’une variation de 1% de la pression osmotique intra-artérielle peut, via cette hormone, modifier de 1000% le débit urinaire afin de maintenir constante la pression osmotique du milieu intérieur ». Un peu plus tard, Carl Gottschalk (1922-1997) parviendra à ponctionner l’anse de Henle du hamster et à démontrer l’utilité physiologique, jusque-là incomprise, de son anatomie si singulière, à savoir l’établissement, par un système de contre-courant avec les artérioles qui la longent, d’un gradient osmotique corticomédullaire, s’avérant indispensable dans le mécanisme de concentration de l’urine (19).
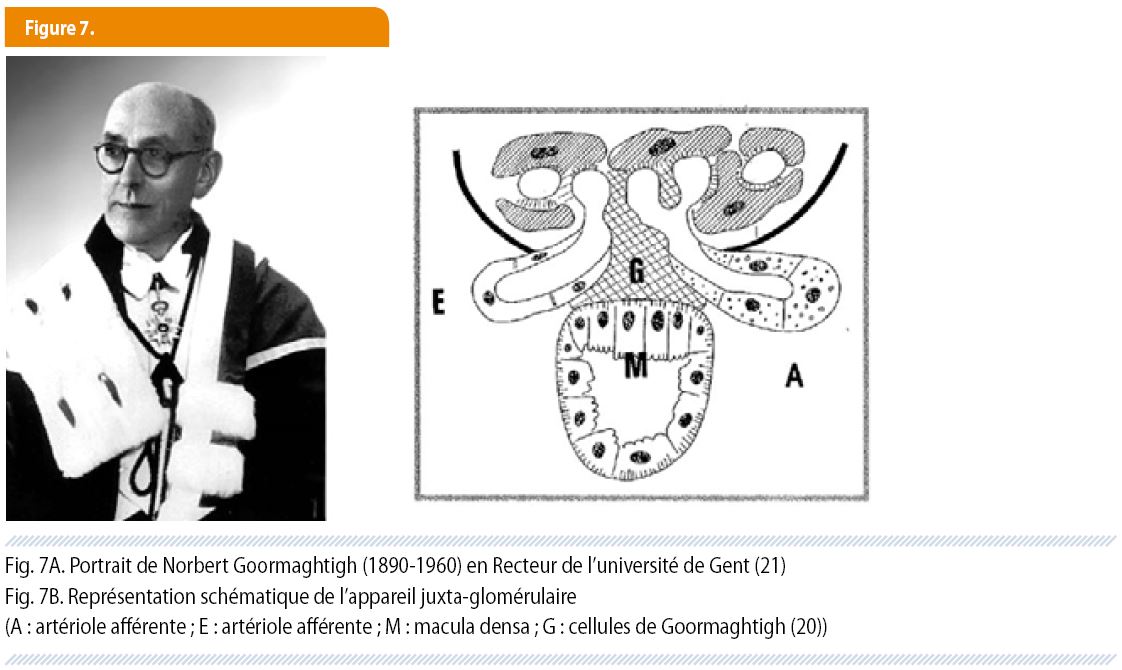
Quant à l’appareil juxta-glomérulaire, nous en devons la description et la préscience du rôle à un Suisse et un Belge. A défaut de devenir peintre, Karl Zimmermann (1861-1935) opte pour la médecine et se consacre à l’histologie au sein de l’Institut d’Anatomie de Berne. Après avoir décrit une structure non filtrante du glomérule, le mésangium, il découvre en 1929 « à la jonction de la branche ascendante de l’anse de Henle avec l’artériole afférente, un accroissement considérable du nombre des noyaux épithéliaux d’un seul côté du tube », structure qu’il appelle « macula densa » (20). Professeur d’anatomopathologie à l’université de Gent, l’Ostendais Nobert Goormaghtigh (1890-1960) complète l’observation de son collègue bernois en décrivant, autour de la macula densa, les cellules du « lacis » qui portent aujourd’hui son nom (fig 7) (21). Et surtout, il prédit, avec une remarquable clairvoyance, le rôle physiologique de l’appareil juxta-glomérulaire, suggérant que « les cellules de la macula densa agissent comme un senseur volémique, régulant automatiquement la circulation glomérulaire » : c’est la clé du mécanisme qu’on appellera après lui le feedback tubuloglomérulaire. C’est, comme le dit F. Reubi, un des plus beaux exemples d’un concept physiologique déduit essentiellement d’observations morphologiques (20).
Ultime réflexion : tout le monde peut se tromper, y compris les plus respectés des maitres en physiologie ! Ainsi, Claude Bernard avait affirmé, en 1855, que la polyurie du diabète était indépendante de la glycosurie (22). Ainsi Homer Smith a nié pendant longtemps les vues de Goormaghtigh sur le rôle de l’appareil juxtaglomérulaire (22) et n’a admis que tardivement, et avec beaucoup de réticence, la réalité de l’existence d’un contre-courant multiplicateur dans l’anse de Henle (23)…
LES OUTILS DIAGNOSTIQUES SE PERFECTIONNENT
Dans la foulée des pionniers de la microscopie urinaire et des créateurs de la physiologie rénale, cette période voit se perfectionner les outils de base de la clinique des maladies rénales : l’analyse de l’urine et du sang.
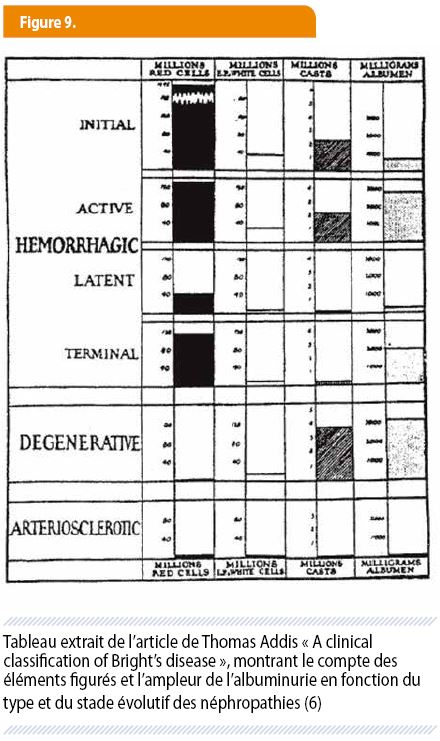
Inauguré par Pierre Rayer et formalisé dès 1844 par Golding Bird, l’examen du sédiment urinaire gagne en précision grâce à la fois à des optiques autorisant un plus fort grossissement, à l’utilisation de la centrifugation et à l’application de colorants spécifiques. L’Anglais Lionel Beale (1829-1906) décrit des cylindres graisseux dans l’urine de patients ayant une protéinurie sévère (fig 8) ; il rédige surtout, en 1869, un traité qui actualise celui de G Bird (24). De nombreux autres ouvrages sur le sujet sont encore publiés à la fin du XIXème siècle. Une contribution majeure de la première moitié du XXème siècle revient à Thomas Addis, dont le nom a déjà été cité. Il a le mérite de quantifier les éléments figurés du sédiment dans une collecte de 12h, le fameux « compte d’Addis », qui fera florès. Il le corrèle au type de néphropathie ainsi qu’au stade évolutif de celle-ci (fig 9) car, écrit-il en 1925 « …grâce au comptage des éléments figurés de l’urine de jour en jour, de mois en mois et d’année en année, nous pouvons désormais construire un tableau de la genèse, de l’acmé et de l’évolution des lésions rénales » (24).

Quant à l’étude de la fonction rénale, l’apport des physiologistes américains est déterminant. La difficulté d’évaluer avec précision le rôle du rein dans l’épuration de différentes substances en se basant sur leur concentration dans le sang et dans l’urine est à la base de la réflexion les conduisant à proposer le concept de clearance (francisé en clairance) : on peut la définir, au sens large, comme le volume de sang totalement épuré d’une substance en un temps donné. Comme on le voit souvent dans l’histoire des sciences, un concept novateur ne s’improvise pas : il capitalise sur une masse critique de données, il tire parti d’un progrès technologique et il est finalement cristallisé par un esprit clairvoyant et visionnaire. C’est le cas de l’utilisation de la clairance en néphrologie. L’essence du concept revient sans doute à un élève de C. Ludwig, Adolf Fick (1829-1901), docteur en médecine et en mathématique. Le « principe » attaché à son nom établit la relation entre le flux et le gradient de concentration d’une espèce chimique diluée. C’est ainsi qu’il propose, dès 1870, de calculer le débit cardiaque en rapportant la consommation d’oxygène à la différence artérioveineuse en oxygène (16). Un demi-siècle plus tard, l’Américain Donald Van Slyke (1883-1971) applique la notion de clairance à la filtration glomérulaire. Dans le même temps, il aura, avec son collègue John P. Peters (1887-1955) considérablement amélioré les techniques d’analyse de l’urée, de la créatinine et des électrolytes (25). John Peters introduit notamment, en clinique, le photomètre à flamme qui mesure désormais en quelques minutes et avec une grande précision la concentration de sodium et de potassium. L’école danoise propose d’utiliser la clairance de la créatinine endogène comme mesure du taux de filtration glomérulaire. Homer W. Smith sélectionne ensuite l’inuline, substance exogène, comme l’index le plus précis de la filtration glomérulaire, car l’inuline est exclusivement filtrée, sans être ni sécrétée par le tubule comme l’est la créatinine ni résorbée. Il introduira aussi la clairance de l’acide para-aminohippurique (PAH) comme marqueur du débit sanguin rénal. H. W. Smith restera en tout cas dans l’histoire de la néphrologie comme le grand zélateur du concept de clairance. Et chacun sait que malgré sa relative imperfection la clairance de la créatinine est devenue la référence universelle des cliniciens pour l’évaluation du débit de filtration glomérulaire (ou GFR en franglais) (13).
A la fin du XIXème siècle une tout autre découverte va marquer d’une pierre blanche l’histoire de la médecine et compléter du même coup l’arsenal diagnostique de l’uro-néphrologie : les rayons X. C’est à Berlin, à la suite de Wilhelm Röntgen, que sont mis au point, vers 1920, les premiers produits de contraste qui permettront de visualiser le rein et les voies urinaires (26). C’est l’observation d’un rehaussement de l’image radiologique de l’appareil urinaire chez des patients recevant de la pyridine iodée à titre de médicament anti-syphilitique qui met sur la piste de l’utilisation de produits de contraste iodés. Le premier à être commercialisé (par la firme Schering) s’appellera « l’Uro-Sélectan » (26). Une autre avancée technologique dans le domaine de l’imagerie est la construction, dès les années 1920, des premiers ordinateurs : ils ouvriront la voie à la tomographie informatisée du rein. Viendra ensuite après la deuxième guerre, l’exploitation des ultrasons, complétée par le recours à l’effet Doppler, avec toutes les applications médicales que nous connaissons aujourd’hui.
En somme, avec le comptage des éléments figurés de l’urine, le dosage aisé des électrolytes sanguins, la clairance de la créatinine et le développement de l’imagerie de l’appareil urinaire, les praticiens rejoignant en 1960 les fondateurs de notre spécialité ont désormais à leur disposition des outils cliniques venant de gagner considérablement en précision.
REMERCIEMENTS
Remerciements à Mmes Cathy Nackom et Chantal Fagot pour la mise en page du manuscrit.
RÉFÉRENCES
- Richet G. Edema and uremia from 1827 to 1905: the first faltering steps of renal pathophysiology. Kidney Int 1993;43:1385-1396.
- Cameron JS, Hicks J. The origins and development of the concept of a “nephrotic syndrome”. Am J Nephrol 2002;22:240-247.
- Fogazzi GB, Ritz E. Novel classification of glomerulonephritis in the monograph of Franz Volhard and Theodor Fahr. Nephrol Dial Transplant 1998;13:2965-2967.
- Toussaint C. Contribution of Paul Govaerts (1889- 1960) to the understanding of oedema and proteinuria. The essential role of physiological knowledge in clinical medicine. Nephrol Dial Transplant 2002;17:1391-1395.
- Lambert P.P. L’albuminurie: tube ou glomérule? Néphrologie d’Hier et d’Aujourd’hui 1994;2:3-6.
- Peitzman SJ. Thomas Addis (1881-1949): mixing patients, rats, and politics. Kidney Int 1990;37:833- 840.
- Glassock RJ. The emergence of the discipline of renal immunopathology. Am J Nephrol 2002;22:248- 253.
- Harlos J, Heidland A. Hypertension as cause and consequence of renal disease in the 19th century. Am J Nephrol 1994;14:436-442.
- de Wardener H.E. Hypertension artérielle et artérioles rénales de Bright à aujourd’hui. Néphrologie d’Hier et d’Aujourd’hui 1994;4:15-21.
- George CR. Development of the idea of chronic renal failure. Am J Nephrol 2002;22:231-239.
- Oliver J, MacDowell M, Tracy A. The pathogenesis of acute renal failure associated with traumatic and toxic injury; renal ischemia, nephrotoxic damage and the ischemuric episode. J Clin Invest 1951;30:1307-1439.
- Eknoyan G. Emergence of the concept of acute renal failure. Am J Nephrol 2002;22:225-230.
- Gottschalk CW. Homer William Smith: a remembrance. J Am Soc Nephrol 1995;5:1984-1987.
- Hoenig MP, Zeidel ML. Homeostasis, the milieu interieur, and the wisdom of the nephron. Clin J Am Soc Nephrol 2014;9:1272-1281.
- Hierholzer K. Carl Ludwig, Jacob Henle, Hermann Helmholtz, Emil DuBois-Reymond and the scientific development of nephrology in Germany. Am J Nephrol 1994;14:344-354.
- Hierholzer K, Ullrich KJ. History of renal physiology in Germany during the 19th century. Am J Nephrol 1999;19:243-256.
- Fine LG. British contributions to renal physiology: of dynasties and diuresis. Am J Nephrol 1999;19:257- 265.
- Giebisch G. The scientific achievements of R.F. Pitts and V. du Vigneaud. Am J Nephrol 2002;22:186-191.
- Cameron JS. Carl Gottschalk - physiologist, bibliophile and historian of nephrology. Am J Nephrol 1999;19:235-242.
- Reubi F. Karl Wilhelm Zimmerman (1861-1935). Le mésangium et l’appareil juxta-glomérulaire. Néphrologie d’Hier et d’Aujourd’hui 1994;4:4-8.
- Eknoyan G, Rubens R, Lameire N. The juxtaglomerular apparatus of Norbert Goormaghtigh--a critical appraisal. Nephrol Dial Transplant 2009;24:3876- 3881.
- Richet GC. Osmotic diuresis before Homer W. Smith: a winding path to renal physiology. Kidney Int 1994;45:1241-1252.
- Gottschalk CW. History of the urinary concentrating mechanism. Kidney Int 1987;31:507-511.
- Fogazzi GB, Cameron JS. Urinary microscopy from the seventeenth century to the present day. Kidney Int 1996;50:1058-1068.
- Epstein FH. John P. Peters and nephrology. Am J Kidney Dis 2001;37:1113-1119.
- Hierholzer K, Hierholzer J. The discovery of renal contrast media in Berlin. Am J Nephrol 2002;22:295- 299