Introduction
Le terme de « Damage Control », que l’on pourrait traduire de l’anglais par « limiter les dégâts », est un concept emprunté à la marine militaire qui a été extrapolé en médecine dans le cadre de la traumatologie grave. Si certains rapports y faisaient déjà allusion de manière sporadique dès la fin des années septante (1), ce n’est qu’en 1993, en se concentrant essentiellement sur le versant chirurgical de la prise en charge, que le terme de « Damage Control Surgery » fut reconnu comme une approche thérapeutique incontournable. Cette approche insiste sur l’importance de pratiquer dans les plus brefs délais, des interventions sommaires, de moins d'une heure, incomplètes certes, mais salvatrices, plutôt que de s’acharner de longues heures à obtenir le rétablissement d’une anatomie quasi parfaite chez un patient qui finira par décéder d’insuffisance d’organes en période postopératoire (2,3). En 2013, son utilisation en médecine pré hospitalière civile a été évoquée dans des situations spécifiques (4). Toutefois, c'est à la suite des attentats de Paris et Bruxelles que son utilisation pour ces blessures de guerre en temps de paix a été recommandée par de nombreux acteurs. Son premier objectif se focalise sur le contrôle rapide de l’hémorragie et de la contamination microbienne et l'admission du patient au plus vite aux soins intensifs pour stabiliser ses fonctions vitales. Après quelques heures ou jours, une chirurgie correctrice extensive est planifiée, avec pour but cette fois de rétablir une anatomie aussi fonctionnelle que possible.
Sans omettre la séquence prioritaire « ABC » d'un patient en détresse vitale, en présence d'un traumatisme grave, le contrôle de l'hémorragie constitue une priorité préalable, ce qui impose une prise en charge en parallèle de plusieurs défaillances et donne tout son sens à une prise en charge multidisciplinaire sous l’autorité d'un team leader dès l'arrivée en salle d'urgences. Un autre enjeu important dans ce contexte est de bien définir quand et pour quel type de patient ce parcours de soins doit être appliqué. Le présent article vise à synthétiser les clefs de la prise en charge à travers les différentes disciplines concernées.
« Damage Control» : pour qui ?
Récemment, le « Damage Control » est devenu un modèle de prise en charge multidisciplinaire impliquant tous les intervenants de la traumatologie depuis la prise en charge pré hospitalière jusqu’à l’admission aux Soins Intensifs. S’il est évident que la survie d’un polytraumatisé grave ne peut se concevoir sans chirurgie ou intervention endovasculaire, il s’agit de choisir la technique la plus adaptée au patient : un patient souffrant de plusieurs fractures n'est pas un polytraumatisé. Il faut donc identifier le patient éligible et si cela semble évident lors d'un afflux de blessés graves par balles ou suite à une explosion, il semble plus difficile pratiquement de repérer le bon patient dans une pratique pré hospitalière plus conventionnelle (4). Le bénéficiaire de choix de cette prise en charge est le polytraumatisé présentant une hémorragie massive en voie de décompensation vers le choc hémorragique, l'hémorragie étant la première cause de décès évitables des patients amenés vivants à l'hôpital.
Sans surprise, c’est dans le domaine de la médecine militaire qu’il a été le plus étudié, plus spécialement en Irak lors de la guerre du Golfe (2 août 1990-28 février 1991) et de la seconde guerre d’Irak (20 mars 2003-18 décembre 2011). Entre ces deux conflits, les statistiques de l’armée américaine font état d’une amélioration drastique de la survie de leurs blessés graves. Même s’il est difficile d’attribuer l’amélioration de la survie des combattants uniquement à la modification de la prise en charge médicale, certaines études attribuent au moins en partie cette amélioration à l’application du « Damage Control Approach » (5,6).
Ce principe de prise en charge expéditif peut s’appliquer également dans un contexte non militaire :
- en traumatologie civile, lors d’hémorragie massive menaçant la vie ;
- dans des contextes moins hémorragiques, lorsque la prévention de lésions secondaires, non causées directement par le traumatisme initial mais induites secondairement par les perturbations physiologiques, peut fortement influencer favorablement le pronostic final du patient, comme en cas de traumatisme crânien ;
- en situation hémorragique grave non traumatique, chirurgicale ou obstétricale ;
- lors d’afflux massif de blessés en situation de catastrophes naturelles ou non. Dans ces circonstances, les capacités d’offre de soins se voient débordées par le nombre des admissions. Pour apporter des soins de base de qualité à un maximum de patients, il faut réduire le temps opératoire consacré à chaque individu afin de ne pas avoir à déplorer un nombre prohibitif de décès en amont du bloc opératoire ;
- en traumatologie en milieu austère (chirurgie humanitaire). Quand les ressources d’amont et d’aval sont limitées, comme c’est le cas lors de la pratique de la chirurgie pour la plupart des ONG dans les pays en crise, l’accent plus qu’ailleurs doit être mis sur la préservation précoce de l’homéostasie de l’organisme. Une chirurgie complexe, longue et coûteuse ne remplit pas le cahier des charges en ces circonstances précaires (7).
«Damage Control » : pourquoi ?
En cas d’hémorragie massive et de remplissage vasculaire nécessaire à sa compensation, l’organisme risque de se voir rapidement précipité dans une spirale négative appelée « triade létale » associant coagulopathie, acidose et hypothermie. Ce phénomène fut souligné dès le début des années quatre-vingt, justifiant le « Damage Control Surgery » espérant endiguer précocement le développement de ce cercle vicieux par un contrôle chirurgical expéditif de l'hémorragie. L’objectif se limitait alors à réduire le temps opératoire au minimum, idéalement moins d’une heure, en se focalisant uniquement sur le contrôle de l’hémorragie et de la contamination microbienne, la fermeture provisoire de la cavité abdominale, voire la non fermeture de celle-ci.
Depuis, une meilleure connaissance de la physiopathologie de cette triade létale a permis de mettre l’accent sur l’importance du traitement non chirurgical, essentiellement hémostatique, de ce « bloody vicious circle » (8).
La coagulopathie
La coagulopathie du traumatisme grave se développe dès les premières minutes suite aux phénomènes inflammatoires que celui-ci déclenche. La physiopathologie en est extrêmement complexe. Les lésions tissulaires libèrent de grande quantité de TPA (activateur tissulaire du plasminogène) ce qui déclenche une fibrinolyse. Ces lésions tissulaires activent aussi en cascade les facteurs de coagulation au départ du Facteur VIIa. Dans un premier temps, ceci aura un effet positif procoagulant, mais secondairement un trouble comparable à la CIVD va s'installer. Parallèlement l’hypoperfusion tissulaire entraîne une augmentation de l’activité de la Thrombomoduline, active la protéine C, qui inactive alors les facteurs Va et VIIIa, et par ailleurs accentue la fibrinolyse. Le polytraumatisé se voit donc plongé dans un état d'anticoagulation et de fibrinolyse spécifique, dont l'importance est parallèle à la gravité du traumatisme (9,10). Logiquement, ce trouble spécifique se voit aggravé par un hématocrite bas, la perte de facteurs de coagulation et des plaquettes causée par l’exsanguination, leur consommation en vaine tentative d'hémostase, leur dilution consécutivement au remplissage vasculaire au moyen de cristalloïdes ou colloïdes. À titre indicatif, après 4 litres de cristalloïdes, la probabilité de voir le patient présenter des valeurs d'INR >1,5 est de 80 %. Sans oublier l’effet négatif « per se » sur la coagulation des hydroxyethylamidons, clairement contre-indiqués dans ce type d’indication. Acidose et hypothermie amplifieront ces troubles de coagulation.
L’acidose
L’hémorragie, en diminuant le contenu sanguin en oxygène dans un premier temps et le débit cardiaque dans un second temps, conduit à une diminution du transport en oxygène poussant l’organisme vers le métabolisme anaérobie, lit de l’acidose métabolique. Cette acidose va aggraver les troubles de la coagulation en diminuant d’avantage encore l’activité des facteurs Va, VII et Xa.
L’hypothermie
Inévitable sur le lieu de l’accident par des phénomènes de convection, d’évaporation, de conduction, elle est ensuite majorée par la diminution de production de température consécutive à la diminution de transport en oxygène. La perfusion d’une quantité importante de solutions de remplissage plus ou moins bien réchauffées vient péjorer celle-ci. La plupart des facteurs de coagulation voient alors leur activité diminuer avec l’hypothermie et la fibrinolyse se majore. En dessous de 34°, la fonction plaquettaire s’altère.
Toutes ces considérations justifient que le « Damage Control Management » débute bien en amont du « Damage Control Surgery » par des mesures visant à :
- prévenir les déperditions thermiques ;
- réduire les pertes sanguines ;
- limiter le recours aux cristalloïdes et prohiber les colloïdes ;
- appliquer des protocoles adaptés de transfusion massive et précoce ;
- limiter l’utilisation d’agents vasoconstricteurs.
Une meilleure connaissance de la coagulopathie aiguë du polytraumatisé a permis d’améliorer la « réanimation hémostatique » de la triade. La transfusion précoce et massive de la « combinaison idéale » des dérivés sanguins, associée à l’utilisation précoce d’acide tranexanique en sont les 2 priorités capitales (10-12).
« Damage Control » : comment ?
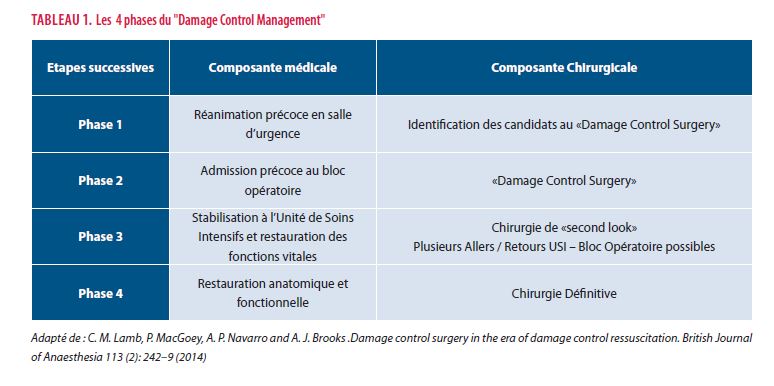
Présumant que la prise en charge pré hospitalière ait été optimale « scoop and run » plutôt que « stay and play », l’approche « Damage Control » se subdivise en 4 phases reprises dans le tableau 1. La phase 4 ne sera qu'évoquée dans cette synthèse.
Les clefs de la prise en charge en salle d’urgence
Dès l'accueil, les objectifs suivants devront être adressés dans l'heure par une équipe entrainée et guidée dans ces différentes étapes par un team leader identifié et expérimenté face à ce type de situation.
1. Prévention des déperditions thermiques
Toutes les mesures à notre disposition doivent être mises en œuvre :
- maintien d'une température ambiante élevée en salle d'urgence et limitation des courants d'air ;
- installation du patient sur un matelas chauffant ;
- examen complet du patient en un minimum de temps ;
- réchauffement passif du patient (ventilateur d’air chaud et couverture appropriée) ;
- réchauffement actif de tous les liquides perfusés, par l’intermédiaire d’un réchauffeur spécifique.
2. Réduction des pertes sanguines
2.1. Contrôle de l’hémorragie
- Contrôle d’hémorragie des membres par la vérification des garrots en place (posés en pré hospitalier) ou en les posant le cas échéant.
- Immobilisation du bassin par ceinture pelvienne en cas de possibilité de fracture pelvienne (suspicion clinique ou accident à haute énergie (piétons, 2 roues, véhicules sinistrés et chutes importantes) (13).
- Contrôle de l’hémorragie non accessible aux garrots par l’utilisation de pansements hémostatiques (HémoclotR) (initiés idéalement en pré hospitalier).
Le contrôle de l’hémorragie a pour but, outre de maintenir la capacité de transport d’oxygène aux organes périphériques et ainsi de limiter l'acidose, d’endiguer la perte de facteurs de coagulation, de limiter les besoins de remplissage et par conséquent de diminuer les risques d'hypothermie.
2.2. Tolérance d’une réanimation hypotensive (sauf en présence d’un trauma crânien)
Plus la pression artérielle sera basse et plus les pertes sanguines avant un contrôle définitif du saignement seront réduites.
- La présence d’un pouls radial cliniquement palpable, qui correspond environ à une pression systolique de 70 mmHg, est un objectif suffisant tant que la source du saignement n’est pas sous contrôle. Toute augmentation de la pression artérielle majorerait les pertes sanguines et conduirait un pas de plus vers l’hypothermie et la perte de facteurs de coagulation (14).
- Chez un sujet conscient, la conservation d’un état de conscience cohérent équivaut à une pression artérielle suffisante.
- Cette hypotension permissive doit toutefois être la plus brève possible afin de limiter l’hypoperfusion tissulaire et le développement d’une acidose métabolique. (Importance d’un tri rapide afin d’identifier au plus vite les bénéficiaires du Damage Control Surgery, seule solution définitive au contrôle des pertes sanguines).
- La mise en place d’un cathéter artériel invasif n’est en rien recommandée car il risque d’induire une perte de temps dans la prise en charge.
- En cas de traumatisme crânien ou de grossesse, les valeurs préconisées d’hypotension permissive restent controversées. Dans le doute il est recommandé de manière empirique de viser une pression systolique de 100 mmHg. Les mêmes recommandations peuvent être faites pour les patients hypertendus connus.
2.3. Utilisation d’acide tranexanique précoce
Cet antifibrinolytique est utilisé pour traiter la fibrinolyse précoce induite par le traumatisme grave (ou l’hémorragie cataclysmique du postpartum). Une dose de 1g sera injectée dès que possible. Cette dose doit être, dans l’idéal, administrée en pré hospitalier mais en tout cas endéans les 3 heures suivant le trauma. Une administration différée est susceptible d’augmenter les pertes sanguines. Dans les recommandations actuelles, cette dose de charge doit être suivie d’une dose de 1g en 8 heures (11,12).
3. Réanimation volémique
3.1. Mise en place de 2 cathéters périphériques de gros calibre et réanimation volémique
- Le cathéter veineux central ne sera jamais envisagé en priorité et on y aura recours uniquement lorsque la mise en perfusion périphérique s’avère impossible.
- Il en va de même pour l’abord intra osseux. Recommandé chez l’enfant en cas d’accès périphérique difficile, il est rarement salvateur dans un contexte traumatique, en cas de pertes sanguines majeures, et encore plus rarement chez l’adulte. Cela doit rester l’abord du dernier recours en attendant mieux : un abord veineux central.
3.2. Transfusion précoce
- Le choix doit immédiatement se porter vers la transfusion de dérivés sanguins afin d’empêcher le déclenchement de la coagulopathie de dilution en administrant au départ du sang O négatif.
- Ces dérivés sanguins doivent être administrés de façon équilibrée.
- En milieu austère le produit idéal est le sang frais, qui apporte à la fois la capacité de transport d’oxygène et les facteurs de coagulation. La survie du patient dépend alors de donneurs dirigés, souvent la famille.
- En milieu médicalement favorisé, le don dirigé est interdit et le sang frais total non disponible. La solution thérapeutique repose sur un mélange de Globule Rouges Concentrés (GRC), de Plasma Frais Congelé (PFC) et de Concentrés Plaquettaires (CP).
- Les recommandations actuelles sont d’administrer successivement 1 GRC + 1 PFC + 1 CP + 1 g de gluconate de Calcium et de recommencer ce cycle jusqu’à l’obtention d’une hémodynamique acceptable (la palpation d’un pouls radial, un état de conscience satisfaisant) (15).
- Actuellement, Il n’y a toujours pas suffisamment d’arguments pour préconiser l’administration de solutions hypertoniques.
4. Réalisation d’un FAST: Focused Assessment Sonography for Traumas
Cet examen échographique sommaire vise deux objectifs :
- le premier, la recherche d’hémorragie non extériorisée, en sachant que 2 causes sur 4 seulement pourront être mises en évidence : L’hémopéritoine et l’hémothorax. L’hémorragie rétro péritonéale et l’hémorragie interne dans les membres inférieurs échapperont à l’examen, cette dernière étant toutefois aisément détectable par l’examen clinique ;
- le second objectif vise à dépister 2 autres causes réversibles de décès différentes de l’hémorragie, à savoir : un pneumothorax suffocant ou une tamponnade cardiaque.
5. Contrôle des voies aériennes
Si le contrôle de l'hémorragie est la priorité absolue en traumatologie grave, il ne faut pas négliger le contrôle des voies aériennes face à une diminution de la conscience, ou une obstruction des voies aériennes, autre cause de décès évitable.
En pré hospitalier, si les premiers intervenants sont des professionnels du contrôle avancé des voies aériennes, une intubation endotrachéale doit être effectuée avant le transport pour tout score de Glasgow inférieur à 8.
En l’absence de cette expertise, l’administration d’oxygène, la manœuvre « chin lift and jaw trust » et la mise en place d’une canule oropharyngée sont les 3 gestes les plus urgents à réaliser, avant le « scoop and run ».
En salle d’urgences, dès l’admission, la prise en charge initiale doit être complétée, en vérifiant la perméabilité des voies aériennes et l’adéquation de la ventilation. Le cas échéant le tube endotrachéal doit être placé à ce moment ou repositionné. Une cricothyrotomie peut parfois s’avérer nécessaire.
6. Bilan radiologique expéditif : Colonne cervicale – Thorax – Bassin
Cette trilogie standard doit être réalisée dans les plus brefs délais.
Elle ne doit en rien ralentir la prise en charge et l’acheminement vers le bloc opératoire.
Dans des services d’urgences plus équipés et où l’accès au scanner est accessible sans délais, on pourrait avoir recours à ce dernier. Le recours à cet examen ne doit en rien retarder la prise en charge et différer l'acte chirurgical. Il doit être réservé aux équipes vraiment routinières.
7. Mise en place d’un drain pleural
En fonction de l’examen clinique orienté vers l’adéquation de la ventilation ou selon les résultats de l’imagerie du thorax ou du FAST, la pose d’un drain thoracique est une priorité absolue dans le cas d’un pneumothorax sous tension et à la fois salvateur et curatif en cas d’hémothorax, puisque dans 80 % des cas, le drainage thoracique suffit à traiter l’hémorragie thoracique.
8. Détection des candidats au « Damage Control Surgery »
La difficulté consiste à repérer, parmi les patients traumatisés admis en salle d’urgence, et ce dans les plus brefs délais, les candidats au « Damage Control Surgery » à côté de ceux qui pourront suivre une filière de soins classiques (12).
L’afflux massif de victimes, conséquence d’une catastrophe naturelle ou de violences humaines, impose ce genre de prise en charge afin de pouvoir prodiguer un maximum de soins vitaux à un maximum de patients.
À côté de ce cas particulier, nous pouvons identifier toute une série de candidats à un « Damage Control Management ». Certains de ces critères sont simples à mettre en évidence et s'imposent par la gravité des lésions ou le contexte du traumatisme, d’autres demandent au clinicien urgentiste de faire une synthèse rapide de plusieurs éléments. Ceux-ci sont repris dans le tableau 2.
Les clefs de la prise en charge peropératoire
Une fois le candidat pour la "Damage Control Surgery" identifié, la chirurgie doit débuter dans les plus brefs délais. Pour ce faire, il doit exister un processus, connu de tous, de mise en alerte précoce de tous les acteurs de soins nécessaires à l'admission au bloc opératoire. La description des techniques chirurgicales applicables dans ce contexte n'entre pas dans l'objectif de cette courte synthèse, chaque spécialité chirurgicale ayant développé ses ripostes spécifiques. Toutes ces ripostes visent le même but: arrêter l’hémorragie sommairement au plus vite et limiter la contamination microbienne pour pouvoir amener un patient en état physiologique réversible à l’unité de soins intensifs.
Une difficulté qui apparaît clairement est d’établir les priorités d’action, et de synchroniser éventuellement les gestes de différents intervenants en ayant comme objectif final d'admettre le patient dans l'heure en unité de soins intensifs. Une stratégie d'action doit être clairement établie depuis le départ de la salle d'urgences vers le bloc opératoire ce qui renforce la fonction du team leader.
Durant ces interventions, les objectifs anesthésiques seront simples et ciblés et tenteront d'approcher la normalité sans prétendre l'atteindre (tableau 3).
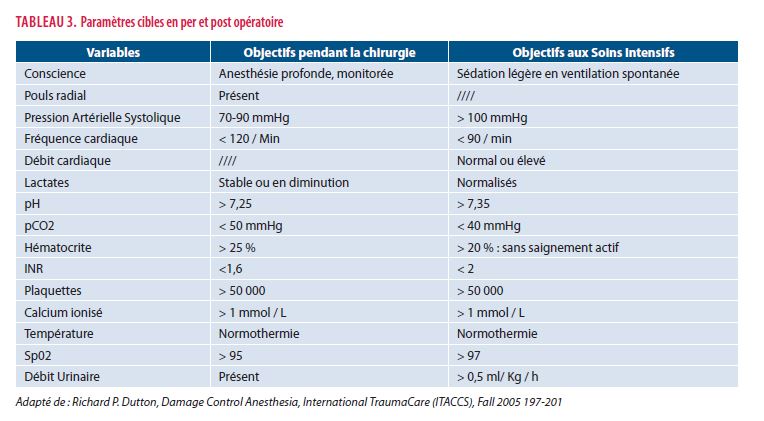
La priorité de la réanimation hémostatique sera de poursuivre la transfusion équilibrée afin de maintenir un ratio idéal en facteurs de coagulation en respectant le principe d'hypotension permissive, toujours impératif tant que l'hémostase chirurgicale n'est pas assurée. L'administration de fibrinogène peut être envisagée, idéalement guidée par les résultats du thromboélastogramme (TEG) Rotem ou Multiplate, monitorings dynamiques de la coagulation (13). La rapidité de la prise en charge souhaitée au bloc opératoire par rapport aux délais nécessaires à l'obtention des résultats des examens dynamiques rend ces tests plus adaptés à la correction des déséquilibres postopératoires aux Soins Intensifs. Une dose de 3 g peut être administrée en l’attente de résultat ou en présence d’un dosage sanguin inférieur à 2g. Le recours au Facteur VIIa recombinant est toujours "off label" dans cette indication (16).
Les clefs de la prise en charge postopératoire
Les mesures traditionnelles de réanimation doivent permettre un retour à la normale des paramètres vitaux et biologiques. Normothermie et correction des troubles de coagulation sont les 2 piliers du traitement. La normalisation des lactates endéans les 24 heures semble être un facteur de bon pronostic (17). Si la cavité abdominale a été fermée, un suivi minutieux de la pression intra abdominale devra être effectué.
Entre 24 et 36 heures postopératoires, une fois l'homéostasie du patient restaurée, ce dernier retournera au bloc opératoire pour établir un nouveau bilan des lésions, compléter le débridement de matériel nécrotique résiduel souvent nécessaire, vérifier l'hémostase et rétablir la continuité intestinale ou à défaut mettre l'un ou l'autre viscère à la peau. Selon l'évolution la cavité abdominale pourra être fermée ou seulement couverte.
Plusieurs « va-et-vient » Soins Intensifs / Bloc Opératoire peuvent s'avérer nécessaires avant une correction anatomique définitive.
Conclusion
Le "Damage Control Management" s'adresse donc à un type de blessé très particulier qui verra ses chances de survie nettement amoindries sans cette approche thérapeutique. Le piège dans lequel il ne faut pas tomber serait d'adopter cette stratégie chez un patient qui n'en bénéficierait pas, voire qui en pâtirait (18). Primum non nocere.
Le tri est donc un paramètre aussi important que la rapidité de la prise en charge. L'expertise des acteurs dans le dépistage des patients bénéficiaires est primordiale et vraisemblablement insuffisante dans le monde de la médecine aiguë actuellement. Le programme d'études médicales aborde peu ce versant de la traumatologie et il faut encourager à l'avenir des formations orientées dans ce domaine pour les acteurs de la médecine aiguë tôt dans leur formation avec de rappels réguliers. Les cours d'ATLS Advanced Trauma Life Support sont encore trop peu suivis par les différents intervenants de la médecine aiguë. Il y a fort à parier que la simulation et le "team working" apporteraient des réflexes aux équipes confrontées à la prise en charge de traumatisé grave.
Recommandations pratiques
À côté de la prise en charge chirurgicale rapide, le concept de damage control associe le contrôle de l'hémorragie par garrot et l'administration d'acide tranexanique en pré hospitalier, le maintien de la normothermie, la transfusion précoce 0-NEG intégrée dans un protocole de prise en charge de l'hémorragie massive, une réanimation hypotensive, la lutte contre l'acidose et la coordination par un team leader en salle d'urgences et au bloc opératoire.
Correspondance
Dr. Jean-Paul Lechat
Anesthésiste - Réanimateur
MSF Belgique - OCB
Grand Hôpital de Charleroi
Service d'anesthésie réanimation
Grand Rue, 3
B-6000 Charleroi
Lechat.jp@ghdc.be
Références
- Burch JM, Denton JR, Noble RD. Physiologic rationale for abbreviated laparotomy. Surg Clin North Am. 1977; 77(4): 779-82.
ouvrir dans Pubmed - Stone HH, Strom PR, Mullins RJ. Management of the major coagulopathy with onset during laparotomy. Ann Surg. 1983; 197(5):532-5.
ouvrir dans Pubmed - Rotondo MF, Schwab CW, McGonigal MD, et al. Damage control: an approach for improved survival in exsanguinating penetrating abdominal injury. J Trauma. 1993; 35: 375-82.
ouvrir dans Pubmed - Tourtier JP, Palmier B, Tazarouret K, et al (2013). The concept of damage control: extending the paradigm in the prehospital setting. Ann Fr Anesth Reanim. 2013; 32:520–6.
ouvrir dans Pubmed - Gawande A: Casualties of war - military care for the wounded from Iraq and Afghanistan. N Engl J Med. 2004; 351(24): 2471–5.
ouvrir dans Pubmed - Goldberg MS. Death and Injury Rates of U.S. Military Personnel in Iraq. Military Medicine. 175, 4: 220.
ouvrir dans Pubmed - Nott D, Veen H, Matthew P. Damage control in the austere environment. Bull Royal Coll Surg Engl. 2014; 96(3): 82-3.
- Duchesne, Juan C; Kimonis, Katerina; Marr, Alan B. Damage Control Resuscitation in Combination with Damage Control Laparotomy: A Survival Advantage. J Trauma Acute Care Surg. 2010; 69(1): 46-52.
ouvrir dans Pubmed - Hess JR, Brohi K, Dutton RP, et al. The coagulopathy of trauma: a review of mechanisms. J Trauma. 2008; 65: 748-54.
ouvrir dans Pubmed - Susen S, Samama CM, Godier A. Physiologie et prise en charge de la coagulopathie de l’hémorragie massive. Hématologie. 2012; 18(6): 523-37.
- CRASH-2 trial collaborators, Shakur H, Roberts I, Bautista R, Caballero J, Coats T, Dewan Y, et al. Effects of tranexamic acid on death, vascular occlusive events, and blood transfusion in trauma patients with significant haemorrhage (CRASH-2): a randomised, placebo-controlled trial. Lancet. 2010; 376: 23-32.
ouvrir dans Pubmed - Van Philbert Y, Holcomb JB, Schreiber MA. Novel concepts for damage control resuscitation in trauma. Curr Op Crit Care. 2017; 23(6): 498–502.
ouvrir dans Pubmed - Lee C, Porter K The prehospital management of pelvic fractures. Emerg Med. J. 2007 Feb; 24(2): 130–133.
ouvrir dans Pubmed - Lamb CM, MacGoey P, Navarro AP, Brooks AJ . Damage control surgery in the era of damage control resuscitation. Br J Anaest. 2014; 113(2): 242–9.
ouvrir dans Pubmed - Holcomb JB, Tilley BC, Baraniuc S et al.. Transfusion of plasma, platelets, and red blood cells in a 1:1:1 vs a 1:1:2 ratio and mortality in patients with severe trauma: the PROPPR randomized clinical trial. JAMA. 2015 Feb 3;313(5):471-82.
ouvrir dans Pubmed - Wigginton JG, Roppolo LP, Pepe PE. Advances in resuscitative trauma care. Minerva Anestesiol. 2011; 77: 993-1002.
ouvrir dans Pubmed - Jansen TC, van Bommel J, Schoonderbeek FJ et al. Lactate study group: Early lactate-guided therapy in intensive care unit patients: a multicenter, open-label, randomized controlled trial. Am J Respir Crit Care Med. 2010; 182: 752–761.
ouvrir dans Pubmed - Braun F, Carli P, Tourtier JP. “Jack of all Trades, Master of None” Damage control is not the universal solution. Ann. Fr. Med. Urgence. 2016. 6: 373-374.