INTRODUCTION
L’arthrodèse lombaire est largement utilisée pour traiter les pathologies malformatives, traumatiques ou dégénératives vertébrales (1). La voie minimale invasive transforaminale (MI-TLIF) que nous utilisons est l’une des plus fréquemment employées par différentes équipes (2). Pendant longtemps des greffons autologues ont été utilisés (3, 4) mais leur prélèvement entraine des effets secondaires largement rapportés dans la littérature (0.76% to 25%) (5, 6). C’est pour cela que d’autres types de greffons ont été développés tels que les BMPs (bone morphogenic proteins), les DBM (demineralized bone matrix) (7-9) et les greffes à base de céramiques. (10-12). Pour ces greffes aussi, de nombreuses complications ont été rapportées atteignant jusqu’à 44% (13-22).
Plusieurs études ont récemment montré que les cellules souches mésenchymateuses pouvaient constituer une source intéressante de greffe osseuse soit à partir des cellules adipeuses soit à partir des cellules de la moelle osseuse, le temps d’ostéodifférenciation étant plus ou moins long (23-28).
Une équipe des Cliniques universitaires Saint-Luc avait déjà utilisé le greffon sur des pseudarthroses chez le cochon et sur des cas cliniques de résection tumorale avec un recul de 48 mois démontrant ainsi leur efficacité et la sécurité de leur usage (29-31). Aucune de ces études n’avait appliqué ce type de greffe sur le rachis humain.
Encouragés par ces résultats nous avons initié une étude ayant pour but d’appliquer les greffons dérivés de cellules souches mésenchymateuses adipeuses sur le rachis humain pour réaliser une arthrodèse lombaire lors des procédures minimales invasives par voie transforaminales. Notre hypothèse était que nous obtiendrions une bonne fusion vertébrale en évitant des prises de greffe autologues.
MÉTHODOLOGIE
Nous avons obtenu l’accord du comité d’éthique sous le numéro N°B403201111681.
Population
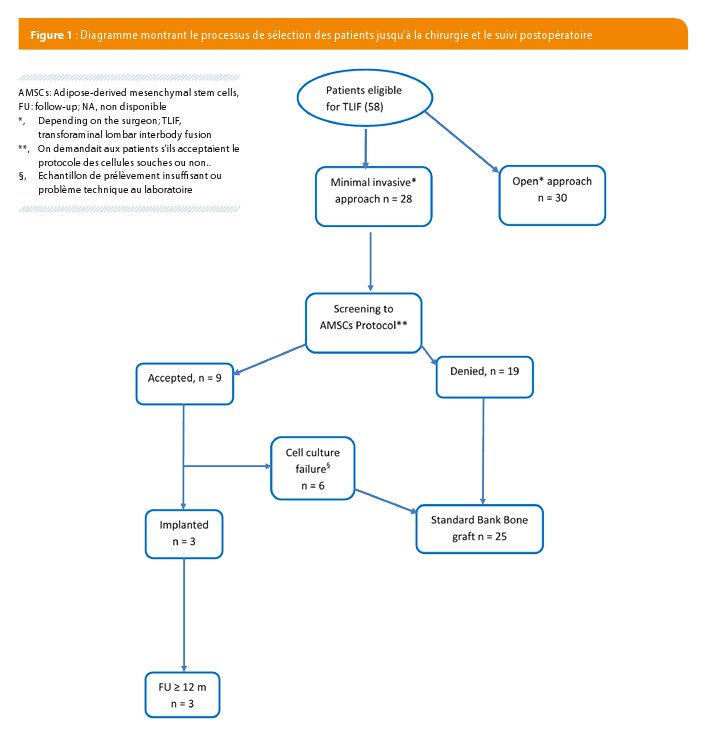
De façon prospective, nous avons identifié et inclus 58 patients souffrant de douleurs lombaires chroniques ou de radiculopathie avec instabilité rachidienne d’origine dégénérative, résistantes au traitement conservateur bien conduit. Vingt-huit de ces patients ont été opérés par MI-TLIF et selon qu’ils avaient ou pas accepté le protocole de prélèvement des cellules adipeuses. Neuf patients ont finalement été prélevés, mais trois seulement ont bénéficié de l’implantation définitive en raison des problèmes techniques lors de la culture au laboratoire. La figure 1 détaille l’évolution des patients.
Préparation de la greffe
Après la liposuccion, la graisse des patients a été transférée à la banque des tissus pour y subir une culture et une différentiation. Le processus a duré environ 90 jours. L’obtention finale de la greffe 3D a comporté plusieurs étapes :
- L’extraction de cellules souches mésenchymateuses obtenues par processus de digestion de tissu adipeux
- La différenciation des cellules souches et leur constitution en structure 3D
- Le contrôle de qualité de l’implant final
La technique chirurgicale
La chirurgie était réalisée environ trois mois après le prélèvement des tissus adipeux. Le patient étant sous anesthésie générale, on l’installe en décubitus ventral sur une table radio transparente, en prenant soin de disposer des boudins sous le thorax et sous les crêtes iliaques. Une première fluoroscopie 2D à l’aide du Zeego (Siemens, Forchheim, Bavaria, Germany) permet de délimiter la zone d’intérêt. Désinfection puis mise en place des champs stériles. On réalise ensuite une incision de 2 cm à 4 ou 5 cm de la ligne médiane du côté de la radiculopathie lorsqu’elle existe. Dilatation des muscles et mise en place d’un écarteur tubulaire (Pipeline; DePuy Spine, Johnson & Johnson, Arlington, USA) jusqu’au contact du massif articulaire et de la lame de la vertèbre sus-jacente à l’espace intervertébral à opérer. Après un nouveau contrôle fluoroscopique confirmant le niveau, on réalise un abord transforaminal pour arriver à l’espace intersomatique et procède à la dissectomie la plus large possible. Après avivement des plateaux vertébraux, on implante la matrice 3D de la greffe osseuse constituée de cellules souches mésenchymateuses ostéodifférenciées. Une dernière phase consiste à implanter les vis pédiculaires en en associant une acquisition des images fluoroscopique 3D à la navigation rachidienne pour obtenir une meilleure précision d’implantation des vis dans les pédicules. Nous avons déjà décrit cette technique dans une autre publication (32).
Évaluation clinique
Tous les patients ont été examinés avant et après l’intervention en utilisant l’échelle visuelle analogique de la douleur (VAS) et le score d’Oswestry Disability Index (ODI).
Évaluation radiologique de la fusion
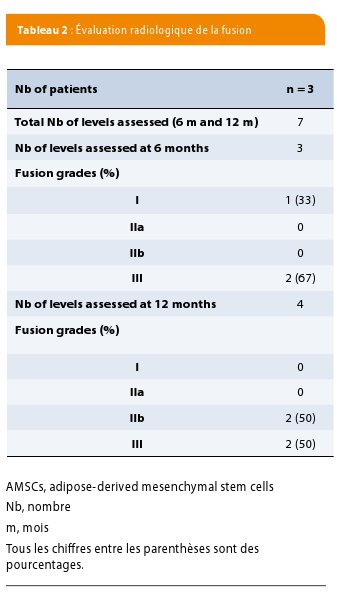
Un scanner a été réalisé chez tous les patients à 6 mois et à 12 mois après l’intervention. Les clichés ont été revus par un même radiologue senior. Trois grades de fusion ont été définis: le grade 3 correspond à un pont osseux continu entre les plateaux vertébraux autour ou à travers la cage intersomatique ; le grade 2B correspond au bourgeon d’os trabéculaire s’étendant d’un plateau vertébral vers l’espace discal sans former de pont continu ; le grade 2A est l’esquisse de bourgeon osseux à partir des plateaux vertébraux et le grade 1 est l’absence d’évidence de formation d’os trabéculaire à partir des plateaux vertébraux (33).
RÉSULTATS
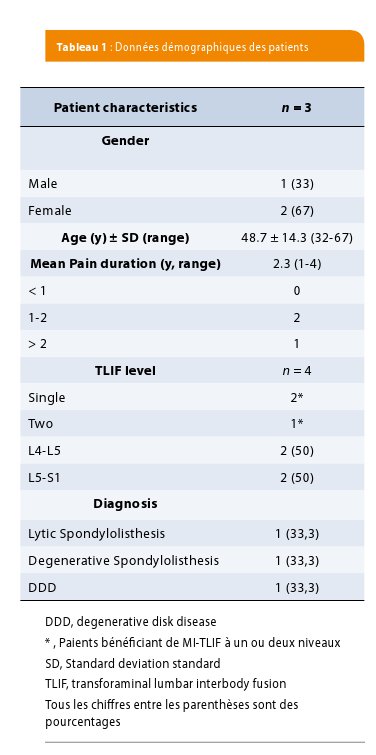
L’âge moyen des patients était de 48,7 ans. La durée moyenne des douleurs avant la prise en charge était de 2,3 ans (Table 1).
Après la chirurgie, aucune détérioration clinique n’a été signalée et les patients implantés ont été suivis pendant au moins 12 mois. Aucune complication n’a été rapportée pendant l’étude. Nous avons observé une amélioration des scores de douleur et d’ODI qui sont passés respectivement de 8.3 ± 0.5 à 2 ± 1.4 et de 47 ± 23 à 31 ± 5. Au total, quatre niveaux étaient implantés avec le greffon de cellules souches, un seul niveau chez deux patients et deux niveaux chez le troisième (Table 1). À douze mois, l’analyse radiologique a permis de démontrer que deux des quatre niveaux avaient atteint une fusion de grade 3. On ne mettait pas en évidence de résorption de greffon ou de formation osseuse réactionnelle en dehors du foyer opératoire (Figure 2).

DISCUSSION
L’objectif de l’étude était l’usage préliminaire de greffon de structure 3D à base de cellules souches ostéodifférentiées à partir du tissue adipeux dans la chirurgie d’arthrodèse rachidienne chez l’humain. L’efficacité et la sécurité avaient déjà été démontrées (31) . Nos résultats montrent que le concept est applicable au rachis humain sans les problèmes de site donneur de greffon comme rapporté en cas de prélèvement de greffon de crête iliaque (34-37).
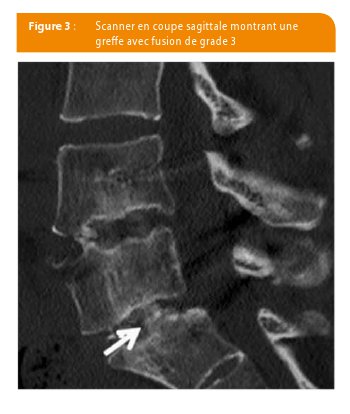
On pourrait discuter l’oncogénicité des facteurs de croissance associés à notre greffon comme cela a été le cas dans la littérature. Plusieurs auteurs ont en effet rapport que la BMP-2, principal facteur de croissance dans la DBM, pouvait être oncogénétique, mais la notion est controversée (38-41). Dans notre étude, le produit final était caractérisé par une très faible concentration de BMP-2. Après extraction protéique, une moyenne de 54 ± 13 ng de BMP-2/g de DBM pouvait être mesurée, en comparaison à 5.5 ± 13.4 ng/g de produit fini (à partir de cellules souches d’origine adipeuse), en comparaison à la série de Rubio et al. (42) Au final la concentration en BMP-2 était réduite de près de 85.2% au cours de la maturation in vitro des cellules souches mésenchymateuses dans notre série. Un autre objectif était l’évaluation de la qualité de la fusion et notre étude montre bien que l’on obtient une bonne fusion avec les cellules souches (Figure 3). La technique de TLIF avec greffon osseux offre des taux de fusion variables dans la littérature de 76 à 93% (43-46). Notre série est une série limitée destinée à prouver un concept. Des études plus étendues sont nécessaires pour confirmer cette voie prometteuse.
CONCLUSION
L’implantation de cellules souches d’origine adipeuse n’a jamais été rapportée dans la littérature en chirurgie rachidienne humaine. Cette série reproductible, sans complication, constitue une série préliminaire ouvrant une voie prometteuse dans la chirurgie de l’arthrodèse lombaire chez des patients souffrant de discarthropathies dégénératives. Des études plus étendues sont attendues pour confirmer le concept.
Abbreviations
AMSCs: adipose-derived mesenchymal stem cells
BMPs: bone morphogenic proteins
CT: computed tomography
DBM: demineralized bone matrix
GMP: good manufacturing practice
MI-TLIF: minimally invasive transforaminal lumbar interbody fusion
ODI: oswestry disability index
VAS: visual analog scale
Affiliations
Correspondance
Références
- Khashan M, Inoue S, Berven SH. Cell based therapies as compared to autologous bone grafts for spinal arthrodesis. Spine 2013; 38:1885-1891.
- Shunwu F, Xing Z, Fengdong Z, Xiangqian F. Minimally invasive transforaminal lumbar interbody fusion for the treatment of degenerative lumbar diseases. Spine 2010; 35:1615-1620.
- Weinstein JN, Lurie JD, Olson PR, Bronner KK, Fisher ES. United States’ trends and regional variations in lumbar spine surgery: 1992-2003. Spine 2006; 31:2707-2714.
- Zdeblick TA. A prospective, randomized study of lumbar fusion. Preliminary results. Spine 1993; 18:983-991.
- Keller EE, Triplett WW.1987) Iliac bone grafting: review of 160 consecutive cases. J Oral Maxillofac Surg 1997; 45:11-14.
- Summers BN, Eisenstein SM (1989) Donor site pain from the ilium. A complication of lumbar spine fusion. J Bone Joint Surg 1989; 71:677-680.
- Epstein NE, Epstein JA (2007) SF-36 outcomes and fusion rates after multilevel laminectomies and 1 and 2-level instrumented posterolateral fusions using lamina autograft and demineralized bone matrix. J Spin Dis Tech 2007; 20:139-145.
- Kang J, An H, Hilibrand A, Yoon ST, Kavanagh E, Boden S. Grafton and local bone have comparable outcomes to iliac crest bone in instrumented single-level lumbar fusions. Spine 2012; 37:1083-1091.
- Thalgott JS, Giuffre JM, Fritts K, Timlin M, Klezl Z. Instrumented posterolateral lumbar fusion using coralline hydroxyapatite with or without demineralized bone matrix, as an adjunct to autologous bone. Spine J 2001; 1:131-137.
- Fischer CR, Cassilly R, Cantor W, Edusei E, Hammouri Q, Errico T. A systematic review of comparative studies on bone graft alternatives for common spine fusion procedures. Eur Spine J 2013; 22:1423-1435.
- Hsu WK, Nickoli MS, Wang JC, Lieberman JR, An HS, Yoon ST, et al. Improving the clinical evidence of bone graft substitute technology in lumbar spine surgery. Glob Spine J 2012; 2:239-248.
- Rihn JA, Kirkpatrick K, Albert TJ. Graft options in posterolateral and posterior interbody lumbar fusion. Spine 2010; 35:1629-1639.
- Boden SD, Schimandle JH, Hutton WC. An experimental lumbar intertransverse process spinal fusion model. Radiographic, histologic, and biomechanical healing characteristics. Spine 1995; 20:412-420.
- Cahill KS, Chi JH, Day A, Claus EB. Prevalence, complications, and hospital charges associated with use of bone-morphogenetic proteins in spinal fusion procedures. JAMA 2009; 302:58-66.
- Epstein NE. Complications due to the use of BMP/INFUSE in spine surgery: The evidence continues to mount. Surg Neurol Intern 2013; 4:S343-352.
- Glassman SD, Dimar JR, Carreon LY, Campbell MJ, Puno RM, Johnson JR. Initial fusion rates with recombinant human bone morphogenetic protein-2/compression resistant matrix and a hydroxyapatite and tricalcium phosphate/collagen carrier in posterolateral spinal fusion. Spine 2005; 30:1694-1698.
- Joseph V, Rampersaud YR. Heterotopic bone formation with the use of rhBMP2 in posterior minimal access interbody fusion: a CT analysis. Spine 2007; 32:2885-2890.
- Meyer RA, Jr., Gruber HE, Howard BA, Tabor OB, Jr., Murakami T, Kwiatkowski TC, et al. Safety of recombinant human bone morphogenetic protein-2 after spinal laminectomy in the dog. Spine 1999; 24:747-754.
- Mindea SA, Shih P, Song JK. Recombinant human bone morphogenetic protein-2-induced radiculitis in elective minimally invasive transforaminal lumbar interbody fusions: a series review. Spine 2009; 34:1480-1484; discussion 1485.
- Schimandle JH, Boden SD, Hutton WC. Experimental spinal fusion with recombinant human bone morphogenetic protein-2. Spine 1995; 20:1326-1337.
- Singh K, Ahmadinia K, Park DK, Nandyala SV, Marquez-Lara A, Patel AA, Fineberg SJ. Complications of spinal fusion with utilization of bone morphogenetic protein: a systematic review of the literature. Spine 2014; 39:91-101.
- Tannoury CA, An HS. Complications with the use of bone morphogenetic protein 2 (BMP-2) in spine surgery. Spine J 2014; 14:552-559.
- Pittenger MF, Mackay AM, Beck SC, Jaiswal RK, Douglas R, Mosca JD, et al. Multilineage potential of adult human mesenchymal stem cells. Science 1999; 284:143-147.
- Schubert T, Xhema D, Veriter S, Schubert M, Behets C, Delloye C, et al. The enhanced performance of bone allografts using osteogenic-differentiated adipose-derived mesenchymal stem cells. Biomaterials 2011; 32:8880-8891.
- Werner BC, Li X, Shen FH. Stem cells in preclinical spine studies. Spine J 2014; 14:542-551.
- Wyles CC, Houdek MT, Crespo-Diaz RJ, Norambuena GA, Stalboerger PG, Terzic A, et al. Adipose-derived Mesenchymal Stem Cells Are Phenotypically Superior for Regeneration in the Setting of Osteonecrosis of the Femoral Head. Clin Orthop Relat Res 2015; 473:3080-3090.
- Yang XF, He X, He J, Zhang LH, Su XJ, Dong ZY, et al. High efficient isolation and systematic identification of human adipose-derived mesenchymal stem cells. J Biomed Sci 2011; 18:59.
- Zhu Y, Liu T, Song K, Fan X, Ma X, Cui Z. Adipose-derived stem cell: a better stem cell than BMSC. Cell biochem Funct 2008; 26:664-675.
- Dufrane D, Docquier PL, Delloye C, Poirel HA, Andre W, Aouassar N. Scaffold-free Three-dimensional Graft From Autologous Adipose-derived Stem Cells for Large Bone Defect Reconstruction: Clinical Proof of Concept. Medicine 2015; (Baltimore) 94:e2220.
- Schubert T, Lafont S, Beaurin G, Grisay G, Behets C, Gianello P, Dufrane D. Critical size bone defect reconstruction by an autologous 3D osteogenic-like tissue derived from differentiated adipose MSCs. Biomaterials 2013; 34:4428-4438.
- Veriter S, Andre W, Aouassar N, Poirel HA, Lafosse A, Docquier PL, Dufrane D. Human Adipose-Derived Mesenchymal Stem Cells in Cell Therapy: Safety and Feasibility in Different “Hospital Exemption” Clinical Applications. PloS one 2015; 10:e0139566.
- Raftopoulos C, Waterkeyn F, Fomekong E, Duprez T. Percutaneous pedicle screw implantation for refractory low back pain: from manual 2D to fully robotic intraoperative 2D/3D fluoroscopy. Advances and technical standards in Neurosurgery 2012; 38:75-93.
- Mannion RJ, Nowitzke AM, Wood MJ. Promoting fusion in minimally invasive lumbar interbody stabilization with low-dose bone morphogenic protein-2--but what is the cost? Spine J 2001; 11:527-533.
- Dimar JR, 2nd, Glassman SD, Burkus JK, Pryor PW, Hardacker JW, Carreon LY. Two-year fusion and clinical outcomes in 224 patients treated with a single-level instrumented posterolateral fusion with iliac crest bone graft. Spine J2009; 9:880-885.
- Dimar JR, Glassman SD, Burkus KJ, Carreon LY. Clinical outcomes and fusion success at 2 years of single-level instrumented posterolateral fusions with recombinant human bone morphogenetic protein-2/compression resistant matrix versus iliac crest bone graft. Spine 2006; 31:2534-2539; discussion 2540.
- Fischgrund JS, Mackay M, Herkowitz HN, Brower R, Montgomery DM, Kurz LT. 1997 Volvo Award winner in clinical studies. Degenerative lumbar spondylolisthesis with spinal stenosis: a prospective, randomized study comparing decompressive laminectomy and arthrodesis with and without spinal instrumentation. Spine 1997; 22:2807-2812.
- Vaccaro AR, Lawrence JP, Patel T, Katz LD, Anderson DG, Fischgrund JS et al. The safety and efficacy of OP-1 (rhBMP-7) as a replacement for iliac crest autograft in posterolateral lumbar arthrodesis: a long-term (>4 years) pivotal study. Spine 2008; 33:2850-2862.
- Bernardo ME, Zaffaroni N, Novara F, Cometa AM, Avanzini MA, Moretta A, et al. Human bone marrow derived mesenchymal stem cells do not undergo transformation after long-term in vitro culture and do not exhibit telomere maintenance mechanisms. Cancer Res 2007; 67:9142-9149.
- Meza-Zepeda LA, Noer A, Dahl JA, Micci F, Myklebost O, Collas P. High-resolution analysis of genetic stability of human adipose tissue stem cells cultured to senescence. J Cell Mol Med 2008; 12:553-563.
- Perrot P, Rousseau J, Bouffaut AL, Redini F, Cassagnau E, Deschaseaux F, et al. Safety concern between autologous fat graft, mesenchymal stem cell and osteosarcoma recurrence. PloS one 2010; 5:e10999.
- Roemeling-van Rhijn M, de Klein A, Douben H, Pan Q, van der Laan LJ, Ijzermans JN, et al. Culture expansion induces non-tumorigenic aneuploidy in adipose tissue-derived mesenchymal stromal cells. Cytotherapy 2013; 15:1352-1361.
- Rubio R, Abarrategi A, Garcia-Castro J, Martinez-Cruzado L, Suarez C, Tornin J, et al. Bone environment is essential for osteosarcoma development from transformed mesenchymal stem cells. Stem cells 2014; 32:1136-1148.
- Lee SC, Chen JF, Wu CT, Lee ST. In situ local autograft for instrumented lower lumbar or lumbosacral posterolateral fusion. J Clin Neurosci 2009 16:37-43.
- Ohtori S, Suzuki M, Koshi T, Takaso M, Yamashita M, Yamauchi K et al. Single-level instrumented posterolateral fusion of the lumbar spine with a local bone graft versus an iliac crest bone graft: a prospective, randomized study with a 2-year follow-up. Eur Spine J 2011; 20:635-639.
- Schizas C, Triantafyllopoulos D, Kosmopoulos V, Stafylas K. Impact of iliac crest bone graft harvesting on fusion rates and postoperative pain during instrumented posterolateral lumbar fusion. Intern Orthop 2009; 33:187-189.
- Sengupta DK, Truumees E, Patel CK, Kazmierczak C, Hughes B, Elders G, Herkowitz HN. Outcome of local bone versus autogenous iliac crest bone graft in the instrumented posterolateral fusion of the lumbar spine. Spine 2006; 31:985-991.