Perspectives modernes en chirurgie prothétique du genou
Emmanuel Thienpont, Daniel Morcillo Marfil, Loïc Thoreau
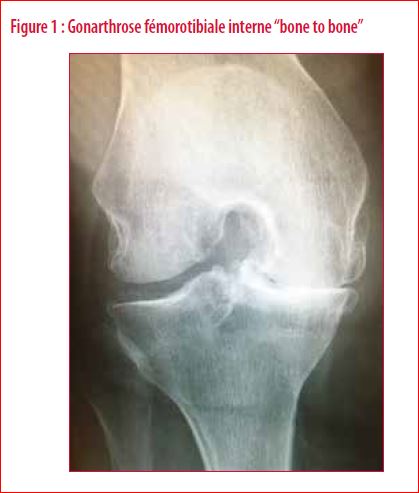
L’arthrose du genou est un problème grandissant au sein de notre société moderne. Cette pathologie handicape fortement la tranche de population la plus active et sédentarise dangereusement nos aînés. Quand l’arthrose est terminale (Figure 1) et le traitement conservateur ne soulage plus le malade, une indication chirurgicale peut exister. Ce traitement consiste en la mise en place d’une prothèse totale ou unicompartimentale de genou. Malheureusement, la prothèse totale de genou est encore associée, dans l’opinion publique, à de mauvais résultats cliniques. En effet, jusqu’à 20 % des patients opérés relatent un genou douloureux et un handicap fonctionnel persistant (1).
L’obtention d’un résultat clinique idéal systématique reste donc un challenge d’actualité pour la communauté orthopédique. La philosophie de l’équipe a toujours été de proposer une solution spécifique au patient : à son âge, à son profil d’activité (travail, sport et loisir), son morphotype et son type d’arthrose. Ce souhait de traitement individuel a amené au développement d’une nouvelle classification du genou en varus selon Thienpont et Parvizi (2). Cette classification permet au chirurgien d’analyser l’origine de la difformité du patient et aide à la traiter.
Au-delà de la maîtrise de l’indication chirurgicale, élément essentiel à un bon résultat, plusieurs questions subsistent concernant le positionnement idéal de l’implant, son design et l’obtention systématique de la position planifiée.
Historiquement, l’implantation de la prothèse totale de genou se faisait en référence à l’axe mécanique du membre inférieur et visait à recréer un interligne articulaire parallèle au sol afin de permettre une meilleure distribution des contraintes dans l’implant et d’augmenter sa survie (3). Les progrès de l’industrie en matière de tribologie et de fixation des implants ont permis de s’écarter progressivement de ce dogme au profit de stratégies de resurfaçage respectant l’anatomie native du patient. En particulier, l’alignement cinématique permet de recréer le mouvement naturel de l’articulation et son équilibre ligamentaire (4).
Cette nouvelle méthodologie centrée sur le patient impose, d’une part le développement d’implant de plus en plus spécifique à l’anatomie individuelle du patient ; de l’autre, une technique chirurgicale ultra précise permettant au chirurgien de placer l’implant en parfaite adéquation avec ses objectifs. Récemment, des implants sur mesure conçus sur base d’un scanner de haute définition ont vu le jour pour satisfaire ces impératifs (5). La technique a déjà montré des résultats très encourageant et est depuis peu disponible en Belgique.
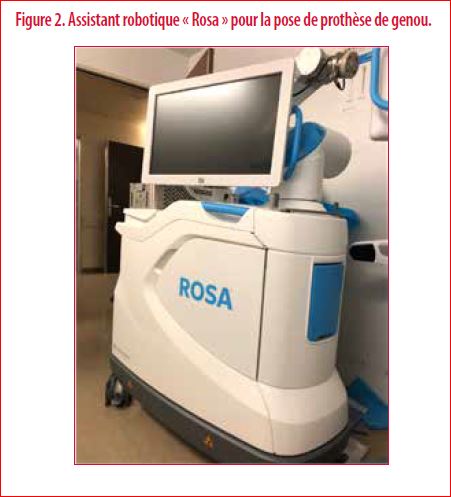
Parallèlement, l’industrie a réalisé d’important progrès en matière d’assistance robotique au chirurgien (Figure 2). Après intégration d’images scanner, ces robots offrent une navigation ultra précise pour la pose de l’implant et rendent un feedback direct sur les tensions ligamentaires au sein de l’articulation (6).
En conclusion, les techniques modernes d’implantation s’écartent progressivement d’une référence purement mécanique et se recentrent sur la biomécanique articulaire et l’anatomie du patient. Cette attitude impose la création d’implants sur mesure pour rencontrer les exigences de variabilité anatomique. Enfin, l’assistance robotique permet au chirurgien de remplir ses objectifs de positionnement.
Références
- Noble PC, Conditt MA, Cook KF, Mathis KB. The John Insall Award: Patient expectations affect satisfaction with total kneearthroplasty. Clinical Orthopaedics and Related Research, 2006; 452:35-43. doi:10.1097/01.blo.0000238825.63648.1e
- Thienpont E and Parvizi J. A new classification for the varus knee. J.Arthroplasty 2016;31:2156-60.
- Whiteside A. Principles of ligament balancing and alignment in total knee arthroplasty. In: The Knee Reconstruction, Replacement and Revision-Vol 1 and 2; Javad Parvisi. ; 2013:2349-2444.
- Rivière C, Iranpour F, Auvinet E, et al. Alignment options for total knee arthroplasty: A systematic review. Orthop Traumatol Surg Res. 2017;103(7):1047-1056. doi:10.1016/j.otsr.2017.07.010
- Batailler C, Swan J, Sappey Marinier E, Servien E, Lustig S. New Technologies in Knee Arthroplasty: Current Concepts. J Clin Med. 2020;10(1):47. doi:10.3390/jcm10010047
- Bautista M, Manrique J, Hozack WJ. Robotics in Total Knee Arthroplasty. J Knee Surg. 2019;32(7):600-606. doi:10.1055/s-0039-1681053
Technologie d’impression 3D métal à des fins de reconstruction prothétique dans la résection des sarcomes
Robin Evrard, Pierre-Louis Docquier, Xavier Banse, Thomas Schubert
Notre service s’est toujours situé à la pointe de la technologie dans la prise en charge des pathologies oncologiques et plus particulièrement des sarcomes (1). Nous avons par le passé développé la technologie des guides de coupe qui nous permet de réaliser une résection d’un sarcome osseux avec des marges résection précises. Cette technologie a fait l’objet de multiples recherches et publications par le passé. Celle-ci a démontré son efficacité à tel point qu’il s’agit aujourd’hui d’une technique mondialement reconnue pour ôter ces tumeurs et ce particulièrement dans des situations complexes (2).
Notre institution a également une énorme expertise dans l’utilisation des allogreffes osseuses à des fins de reconstruction tissulaire. Ceci fait suite au développement d’une banque de tissus par le professeur Christian Delloye en 1982. Si les travaux de recherche et l’expérience développée au cours des dernières années ont permis des avancées spectaculaires dans ces techniques de reconstruction et de sauvetage des membres, certaines limites critiques nous sont apparues avec l’usage de ces greffons.
En effet, certains sites d’implantation sont propices aux échecs de reconstruction par allogreffes. À cet égard, le bassin est particulièrement complexe à traiter. Les résections de sarcomes du pelvis sont des chirurgies extrêmement complexes tant pour la prise en charge oncologique, pour le geste de résection chirurgicale mais également pour le geste de reconstruction. Nous avons dans le passé utilisé des allogreffes coupées avec des guides de coupe en miroir de la zone de résection. Les greffes osseuses ont malheureusement assez rapidement montré leurs limites : ces tissus restent dévitalisés et présentent dès lors de nombreuses complications lors de leur implantation et de leur suivi (e.g. fracture, descellement prothétique, infection, etc.) (3).
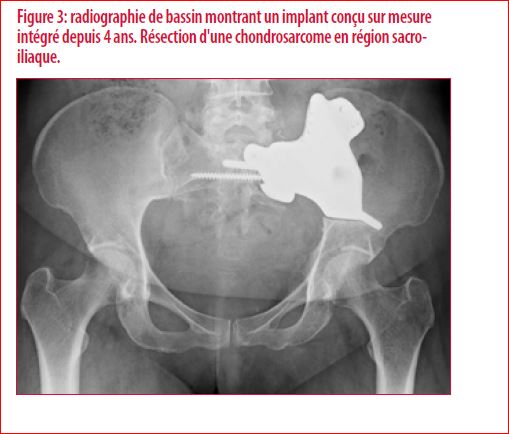
En partenariat avec des ingénieurs, une solution alternative a été développée. L’utilisation de l’impression 3D de métal et plus particulièrement de titane poreux a permis la création de pièces sur mesure pour remplacer les structures réséquées chirurgicalement (Figure 3).
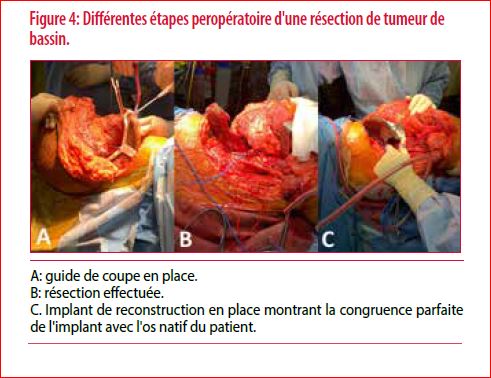
Le principe de fonctionnement reste le même : la délinéation de la tumeur est réalisée sur les coupes d’I.R.M., les ingénieurs réalisent un recalage de l’I.R.M. sur le CT scan, la superposition des différentes coupes avec leur délinéation permet de définir un volume, des marges de sécurité sont prises autour de la tumeur et un plan de coupe est choisi, ces plans de coupe vont définir le volume de résection. À partir de ce volume de résection défini par un fichier STL, les guides de coupe seront créés. Ces fichiers vont ensuite servir à la création d’une pièce de reconstruction. Cette pièce comportera un élément prothétique et ses moyens de fixation. Il en ressort une congruence parfaite entre la zone de résection et l’implant ainsi créé sur mesure pour le patient (Figure 4). Afin de favoriser la stabilité au long cours de l’implant, la structure imprimée à l’interface entre l’implant et l’os natif du patient est conçue poreuse. Le titane est un métal connu pour ses propriétés biocompatibles. Il en ressort un implant qui s’ostéo intègre en trois à quatre mois.
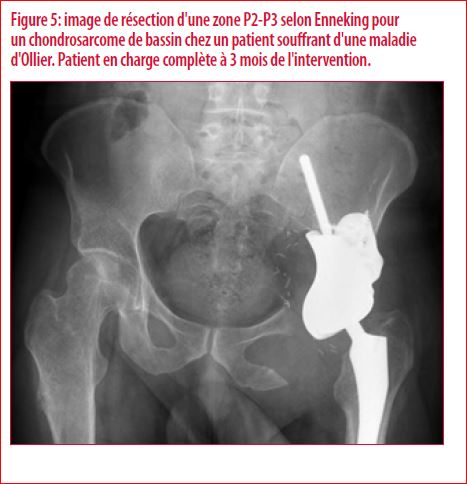
Si les applications pour cette technologie sont relativement rares et les implantations réalisées fort récentes, des résultats à court et moyens terme sont néanmoins fort impressionnants (Figure 5). Il s’agit ici d’une technologie nouvelle qui nous permet de réaliser des reconstructions complexes de manière plus fiable mais également plus rapide diminuant ainsi les risques pour le patient. La planification des interventions n’en reste pas moins complexe et nécessite d’intégrer des principes d’ingénierie, de biologie et de chirurgie de pointe au service du patient.
Références
- Malherbe C, Crutzen B, Schrooyen J, Caruso G, Lecouvet F, Detrembleur C, Schubert T, Docquier PL. Assessment of Resection Margins in Bone Tumor Surgery. Sarcoma, 2020; e5289547 https://www.hindawi.com/journals/sarcoma/2020/5289547/ (2020).
- Evrard R., Schubert T., Paul L, Docquier P.-L. Resection margins obtained with patient-specific instruments for resecting primary pelvic bone sarcomas: A case-control study. Orthop. Traumatol. Surg. Res.2019; 105:781–787.
- Delloye C, Banse X., Brichard B, Docquier PL, Cornu O. Pelvic Reconstruction with a Structural Pelvic Allograft After Resection of a Malignant Bone Tumor. JBJS; 2007, 89: 579–587.
Utilisation de greffons d’os spongieux dans les prothèses totales d’épaules inversées
Nathalie Pireau, Jean-Emile Dubuc, Olivier Cornu, Ludovic Kaminski
L’épaule douloureuse est un motif fréquent de consultation en médecine générale. L’anamnèse et l’examen clinique sont la clé de voûte de la mise au point des douleurs de l’épaule. Le bilan d’imagerie permet de confirmer le diagnostic évoqué.
L’omarthrose est une pathologie fréquente. Lorsque les traitements médicaux sont épuisés, le recours à une prothèse d’épaule est une option actuellement validée. Différents types de prothèse d’épaule sont à notre disposition, dont la prothèse totale d’épaule inversée.
La prothèse d’épaule inversée avait été initialement développée pour traiter les arthroses gléno-humérales avec atteinte sévère de la coiffe des rotateurs. Au fil du temps, les indications d’arthroplastie d’épaule inversée se sont élargies. Actuellement, elle est indiquée en cas d’omarthrose avec atteinte de la coiffe des rotateurs, rupture massive et irréparable de la coiffe des rotateurs, arthropathie inflammatoire, certaines fractures de l’humérus proximal ou séquelles de fracture, et reprises de prothèse d’épaule anatomique ou d’hémiarthroplastie.
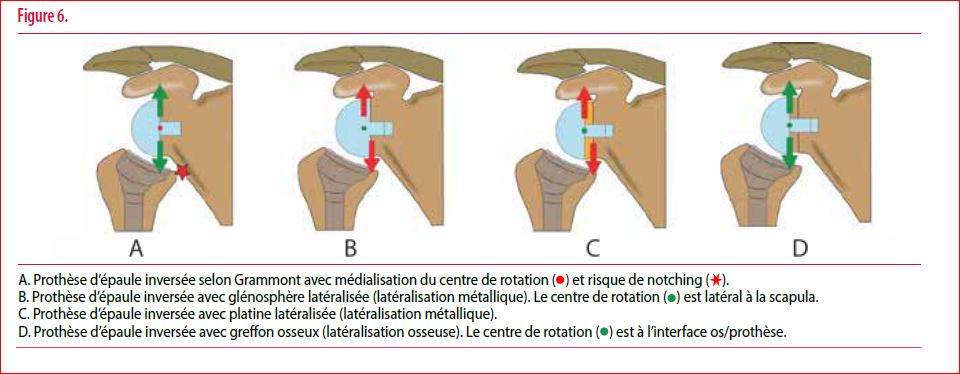
Le concept de la prothèse totale d’épaule inversée (figures 6A et 7C), développé en 1985 par Paul-Marie Grammont, consiste en une médialisation du centre de rotation gléno-huméral et un abaissement de l’humérus. Ceci permet d’augmenter le bras de levier du deltoïde qui devient le moteur de l’élévation de l’épaule et peut ainsi fonctionner avec une coiffe des rotateurs faible ou absente. L’inconvénient de cette médialisation du centre de rotation gléno-huméral est l’apparition d’un possible conflit entre l’humérus et le pilier de la scapula (appelé notching) lors des mouvements d’adduction et de rotation du bras, provoquant au fil du temps une usure du polyéthylène et une érosion de la glène. Les deux autres inconvénients inhérents à cette médialisation du centre de rotation gléno-huméral sont la limitation des mouvements en rotations interne et externe par conflit mécanique, ainsi que, plus accessoirement, la perte du galbe de l’épaule.
Afin de contourner ces problèmes secondaires à la conception de l’implant développé par Grammont, plusieurs auteurs ont proposé de latéraliser le centre de rotation en créant un décalage au niveau de la glène (offset). Deux possibilités s’offrent au chirurgien pour augmenter l’offset : soit il utilise une glénosphère et/ou une embase (platine) latéralisée (latéralisation métallique, figures 6 B et C et figure 7 A et 7 D), soit il place un greffon osseux entre la glène et la glénosphère (latéralisation osseuse, figure 6 D et figure 7B et 7E). L’avantage de la latéralisation osseuse est de garder le centre de rotation à l’interface os-prothèse. Cette greffe permet de diminuer les forces de cisaillement au niveau du composant glénoïdien avec, en subséquent, une diminution du risque de descellement glénoïdien. L’autre avantage majeur du greffon osseux est de pouvoir compenser une perte osseuse glénoïdienne, souvent présente dans les reprises de prothèse, et nécessitant fréquemment une correction dans plusieurs plans.
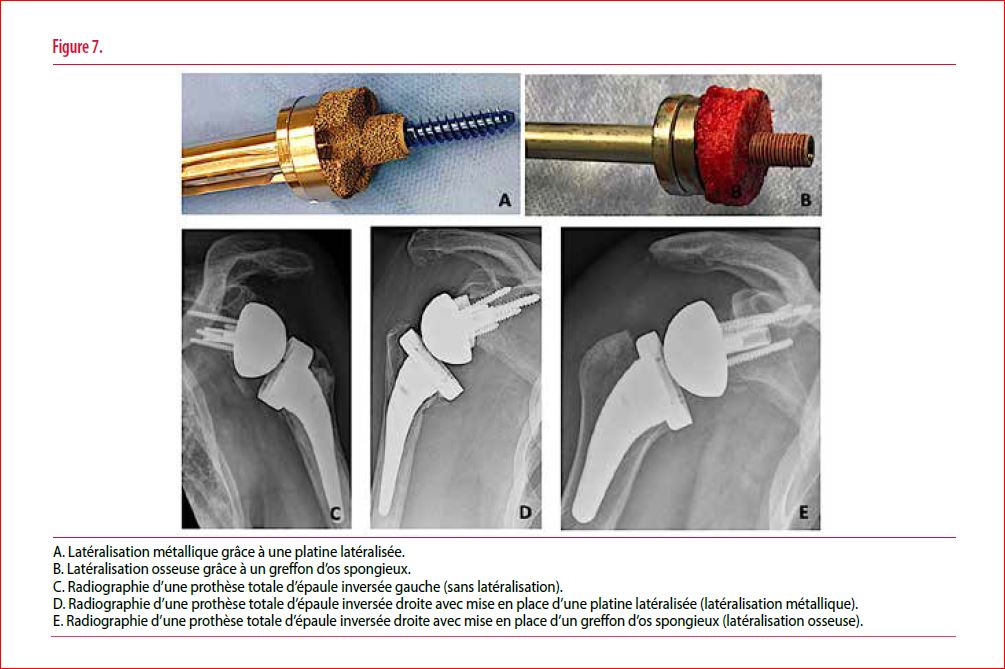
Le greffon osseux peut être aisément prélevé aux dépends de la tête humérale en utilisant un ancillaire spécifique. La prise du greffon osseux au niveau de la tête humérale est impossible si la qualité osseuse est médiocre ou en cas de reprise de prothèse d’épaule. Dans ces cas de figures, une autogreffe ou une allogreffe peuvent être utilisées. La première possibilité consiste à prélever un greffon tricortical au niveau de la crête iliaque, mais cela augmente la durée opératoire et le risque de complications potentielles (douleur postopératoire, hématome, lésions nerveuses ou artérielles, …). L’autre option est l’utilisation d’une allogreffe, à savoir un greffon d’os spongieux, préalablement confectionné aux bonnes dimensions à la banque d’os de Saint-Luc. Facilement accessible pour le chirurgien, c’est cette dernière technique que nous utilisons aux Cliniques universitaires Saint-Luc depuis plusieurs années avec de bons résultats sur le plan fonctionnel ainsi qu’en termes de consolidation osseuse.
Références
- Boileau P, Watkinson DJ, Hatzidakis AM, Balg F. Grammont reverse prosthesis: design, rationale, and biomechanics. J Shoulder Elbow Surg. 2005;14(1 Suppl S):147S-161S. doi: 10.1016/j.jse.2004.10.006. PMID: 15726075.
- Boileau P, Moineau G, Roussanne Y, O’Shea K. Bony Increased Offset-Reversed Shoulder Arthroplasty (BIO-RSA). JBJS Essent Surg Tech. 2017;7(4):e37. doi: 10.2106/JBJS.ST.17.00006. PMID:30233972; PMCID: PMC6132994.
- Boileau P, Morin-Salvo N, Bessière C, Chelli M, Gauci MO, Lemmex DB. Bony increased-offset-reverse shoulder arthroplasty: 5 to 10 years’ follow-up. J Shoulder Elbow Surg. 2020;29(10):2111-2122. doi: 10.1016/j.jse.2020.02.008.
Quand la micro comble le macro…
Xavier Libouton, Olivier Barbier
La traumatologie, les lésions tumorales, les sepsis ou les anomalies congénitales peuvent engendrer des défects ostéo-tissulaires vastes avec un retentissement fonctionnel important. La planification de la prise en charge de tels défects nécessite d’abord la réalisation d’un cahier de charge précis. La question primordiale est de savoir de quels types de tissus le greffon vascularisé doit-il être composé ?
Le corps humain permet d’envisager une multitude de greffons vascularisés. Ils peuvent être d’ordre cutané, myo-cutané, neuro-myo-cutané, osseux, etc. Il s’agit de greffons autologues qui ont l’avantage d’être histocompatibles, ostéoinducteurs et ostéoconducteurs. Cela permet d’obtenir une bonne intégration au niveau du site receveur. En outre, il est important de préserver la vascularisation de ces greffons. Ils peuvent donc être tout d’abord mobilisés localement. Le greffon reste pédiculé dans ce cas. Si une mobilisation locale ne peut être envisagée, il faut alors recourir à une dissection fine du pédicule alimentant le greffon. Le greffon est alors prélevé et réimplanté au niveau du site receveur. On parle de greffons libres. La phase de dissection ainsi que de réimplantation nécessitent un recours à la microchirurgie. Cette technique date principalement du début des années 60. Il s’agit d’une chirurgie assistée par microscope et qui consiste principalement en la réalisation d’anastomoses vasculaires ou nerveuses. L’ordre de grandeur est du millimètre (diamètre des anastomoses = 1 à 2 mm). La microchirurgie est une technique chirurgicale qui n’est pas l’apanage d’une spécialité chirurgicale particulière. Elle est utilisée par les ORLs, la maxillo-faciale, l’orthopédie, la chirurgie plastique, etc.
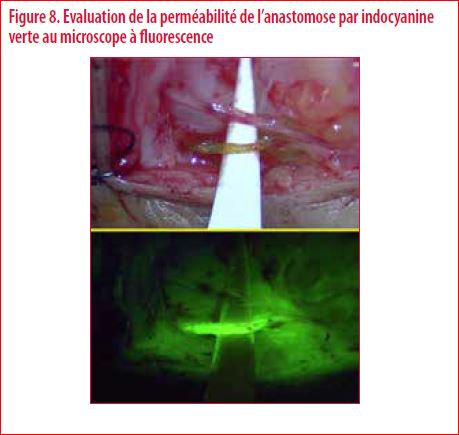
Actuellement, on constate même l’émergence de la supermicrochirurgie (1). Elle est définie comme la microchirurgie appliquée aux vaisseaux de diamètre inférieur à 0,800 mm. Cela permet d’affiner encore le type de prélèvement et de diminuer entre-autre la morbidité du site de prélèvement. Un exemple d’application est le prélèvement de tissu cutané vascularisé de très faible épaisseur au niveau de la cuisse pour couvrir une région malléolaire délabrée par un traumatisme. Au niveau peropératoire, les derniers microscopes sont maintenant équipés de caméras infrarouges. L’intérêt est de pouvoir évaluer le flux sanguin en peropératoire. La perméabilité des anastomoses réalisées peut ainsi être appréciée en injectant de l’indocyanine (Figure 8). L’indocyanine verte est actuellement le traceur fluorescent le plus utilisé et parfaitement détecté par une caméra infrarouge.
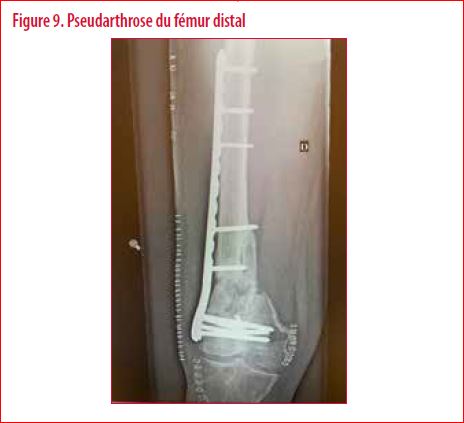
Au niveau orthopédique, toutes ces évolutions permettent bien évidement d’élargir le champ des indications chirurgicales et d’améliorer de manière significative la qualité du geste en peropératoire (2, 3). A titre d’illustration, on peut détailler le cas de ce patient âgé d’une quarantaine d’années victime d’un accident de moto. Il présentait principalement un traumatisme sévère du fémur distal. Pris en charge à de multiples reprises par différents chirurgiens, il nous est adressé pour cette pseudarthrose réfractaire à l’ensemble des techniques chirurgicales usuelles pour ce type de pathologie (Figure 9).
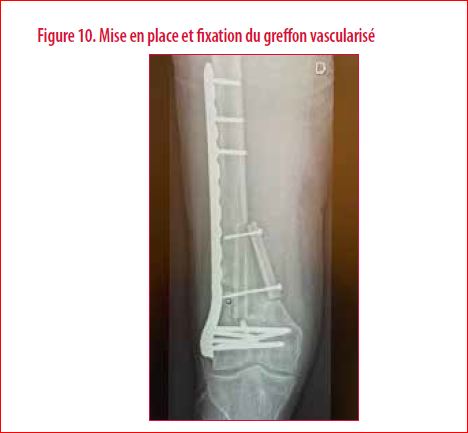
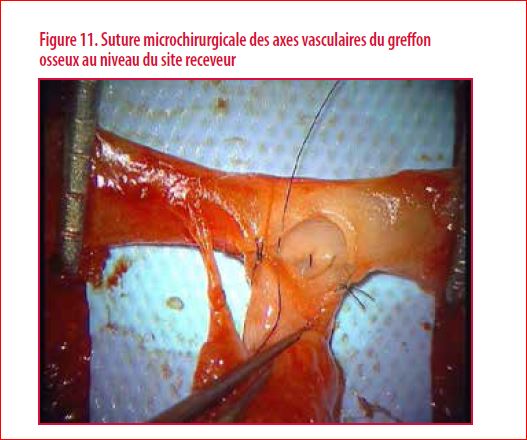
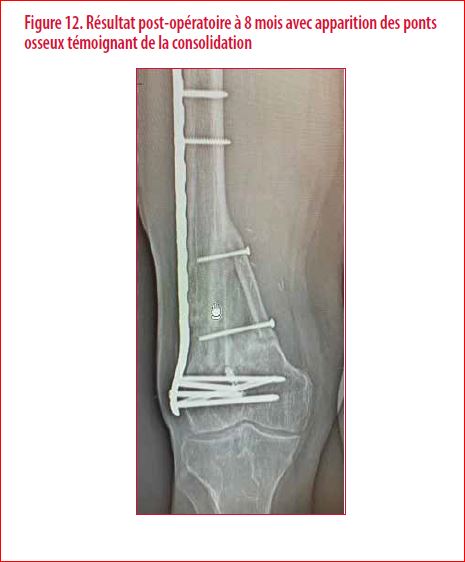
Une indication de cure de pseudarthrose par transfert d’un greffon osseux vascularisé libre fut proposé et accepté par le patient. Le choix du greffon osseux vascularisé libre se porta sur un péroné vascularisé prélevé sur la jambe controlatérale. Le bilan préopératoire nécessite la réalisation d’un bilan vasculaire (très souvent un angioscanner) du site receveur. L’intérêt est surtout de s’assurer de la perméabilité des vaisseaux receveurs pour la réalisation des anastomoses vasculaires (artère + veine). L’intervention en elle-même est souvent longue et méticuleuse. Elle comporte une foule de détails aussi importants les uns que les autres ainsi qu’une anticipation permanente. Le péroné controlatéral est prélevé en préservant bien son pédicule artério-veineux. Le greffon osseux obtenu est dès lors disséqué sous microscope. Dans le cas qui nous intéresse, l’objectif était de pouvoir séparer le greffon osseux prélevé en deux baguettes tout en conservant la continuité vasculaire indispensable à la consolidation espérée. Le site receveur est alors préparé. Le greffon osseux est disposé dans les logettes préparées. Il est stabilisé par deux vis en veillant à ne pas interrompre l’axe vascularisant la double baguette (Figure 10). Les sutures microchirurgicales sont réalisées (Figure 11). Le post-opératoire immédiat comporte surtout une surveillance hémodynamique rapprochée. La figure 12 illustre le résultat à environ 8 mois post-opératoire avec une consolidation obtenue. En conclusion, l’utilisation des greffons vascularisés bien que connue depuis de nombreuses années est une technique chirurgicale en constante évolution. Elle a bénéficié d’avancées techniques non négligeables au cours de ces dernières années aussi bien au niveau de la planification préopératoire que dans la réalisation de l’intervention en elle-même. Cependant, elle reste complexe, nécessite un important déploiement de moyens et ne doit être utilisée qu’à bon escient. En effet, les complications peuvent parfois être importantes (4)…
Références
- Hong JPJ, Song S, Suh HSP. Supermicrosurgery: Principles and applications. J Surg Oncol. 2018;118(5):832-839.
- Petrella G, Tosi D, Pantaleoni F, Adani R. Vascularized bone grafts for post-traumatic defects in the upper extremity. Arch Plast Surg. 2021;48(1):84-90.
- Pulos N, Kollitz KM, Bishop AT, Shin AY. Free Vascularized Medial Femoral Condyle Bone Graft After Failed Scaphoid Nonunion Surgery. J Bone Joint Surg Am. 2018 ; 15;100(16):1379-1386.
- Ou Q, Wu P, Zhou Z, Pan D, Tang JY. Complication of osteo reconstruction by utilizing free vascularized fibular bone graft. BMC Surg. 2020;20(1):216.
Affiliations
Service de Chirurgie Orthopédique et Traumatologie, Cliniques universitaires Saint-Luc UCL, Université Catholique de Louvain, Bruxelles, Belgique
*Contributeurs équivalents
Correspondance
Pr Olivier Cornu
Cliniques universitaires Saint-Luc
Service de Chirurgie Orthopédique et Traumatologie
Avenue Hippocrate 10
B-1200 Bruxelles