(P)ré-habilitation en transplantation hépatique : vers une médecine plus holistique
Géraldine Dahlqvist
D’abord utilisé en gériatrie, le concept de fragilité est défini par une réduction de la résilience physiologique, rendant l’individu plus susceptible aux stress physiologiques et pathologiques. Les maladies hépatiques chroniques, dont la cirrhose est le stade ultime, entrainent des modifications métaboliques augmentant le risque de développer de la fragilité, notamment via une réduction de la synthèse protéique ou via une hyperammoniémie elle-même toxique pour les muscles. Ces modifications sont également à l’origine d’une dénutrition progressive accentuant ce phénomène. La cirrhose favorise donc la fragilité, qui en elle-même majore le risque de décompensation cirrhotique entrainant un cercle vicieux menant à une dégradation progressive de la situation fonctionnelle globale du sujet et de sa fonction hépatique occasionnant inévitablement des complications pouvant à terme mener au décès. Les score de Child-Pugh ou de MELD ne témoignent malheureusement pas correctement de cette réalité.
En 2017, une équipe américaine a déterminé un index de fragilité, le Liver Frailty Index (LFI) pour les patients souffrant d’une cirrhose et nécessitant une transplantation hépatique, considérant que les patients fragiles nécessitaient une priorisation en liste d’attente de greffe quel que soit leur score MELD. L’idée était de définir un score à partir de variables fonctionnelles faciles à obtenir en routine: le genre, la mesure de la force de préhension avec un dynamomètre, un test d’équilibre et un test de lever de chaise (temps pour obtenir 5 répétitions). Ce LFI a démontré une capacité à prédire la mortalité en liste d’attente et après la transplantation hépatique (1). De plus, il a été récemment démontré qu’il permettait de prédire la qualité de vie des patients après la transplantation hépatique (2). Mais, est-il possible d’améliorer ces paramètres via des interventions spécifiques ? Les données s’accumulent pour démontrer l’importance de l’exercice physique dans la prise en charge de nombreuses pathologies chroniques et dans la préparation des interventions chirurgicales plus ou moins lourdes, c’est l’« Exercise Medicine ». Dans le contexte chirurgical, le but est de réduire la réponse au stress chirurgical permettant de diminuer la morbidité post-opératoire et la durée d’hospitalisation (3). Forts de ces connaissances, les spécialistes en transplantation tentent maintenant d’étudier l’impact d’une pré-habilitation et d’une réhabilitation sur les paramètres musculaires, nutritionnels et la fragilité afin d’évaluer l’impact sur la morbidité et la mortalité péri-greffe (4). Des études randomisées évaluant des interventions nutritionnelles et kinésithérapeutiques sont attendues. Elles sont néanmoins difficiles à mener pour différentes raisons : hétérogénéité de la population en attente de greffe hépatique, manque d’adhérence à un projet de réhabilitation soutenu, difficultés d’améliorer le statut nutritionnel chez les patients Child-Pugh C, …
L’étude PRIMER a cependant permis de démontrer que de telles études étaient réalisables moyennant des dispositifs de rappels et d’encouragements par sms, le prêt d’une montre connectée et un incitant financier. Elle a pu démontrer une augmentation du nombre de pas quotidiens significativement plus importante chez les patients dans le bras interventionnel par rapport au bras contrôle (5). C’est dans ce contexte que l’INAMI a développé, avec les professionnels du secteur de la transplantation abdominale, un trajet de soin de pré-habilitation à la greffe et réhabilitation jusqu’à deux années post-greffe hépatique. Ce trajet comprend une évaluation nutritionnelle et fonctionnelle complète des patients par un spécialiste en médecine physique en collaboration avec les paramédicaux et les hépatologues et offre des possibilités accrues de suivis diététiques, kinésithérapeutiques et psycho-sociaux. Ce trajet de soin prendra effet à partir du 1er février 2024. Il nous permettra d’obtenir des meilleurs résultats tant en termes de morbi-mortalité mais également en termes de qualité de vie.
Références
- Wang M, Shui AM, Ruck J, et al. The liver frailty index is a predictor of healthcare utilization after liver transplantation in older adults. Clin Transplant. 2023;e15219.
- Lai JC, Shui AM, Duarte-Rojo A, et al. Association of Frailty With Health-Related Quality of Life in Liver Transplant Recipients. JAMA Surg. 2023;158(2):130–8.
- Joliat G-R, Kobayashi K, Hasegawa K, et al. Guidelines for Perioperative Care for Liver Surgery: Enhanced Recovery After Surgery (ERAS) Society Recommendations 2022. World J Surg. 2023;47(1):11–34.
- Annema C, De Smet S, Castle EM, et al. European Society of Organ Transplantation (ESOT) Consensus Statement on Prehabilitation for Solid Organ Transplantation Candidates. Transpl Int. 2023;36:11564.
- Serper M, Jones LS, Clement T, Reddy RK, Reese PP. A randomized, controlled, prehabilitation intervention to maximize early recovery (PRIMER) in liver transplantation. Liver Transpl. 2024;30(1):10–9.
Les traitements des MICI : quoi de neuf en 2023 ?
Olivier Dewit
Au cours des dix dernières années, le nombre de traitement disponible dans les maladies inflammatoires chroniques intestinales (MICI) s’est considérablement étoffé. Le tableau reprend tous les traitements actuellement disponibles et remboursés dans les MICI (Figure 1). Ceux utilisés ou remboursés dans les 2 pathologies sont indiqués en noir, ceux spécifiques à la maladie de Crohn (MC) sont en bleu et ceux spécifiques à la rectocolite (RC) sont en vert.
Durant les derniers mois, deux nouveaux médicaments se sont ajoutés à ceux déjà disponibles (Figure 1) : le risankizumab (RZB - Skyrizi®) dans la MC et l’upadacitinib (UPA - Rinvoq®) dans la RC.

Le RZB est un nouveau biologique, anti-IL-23 sélectif, disponible en deuxième ligne (après anti-TNF ou anti-intégrine) dans la MC depuis le 1er septembre 2023 (1,2). Il s’agit d’une évolution de son « cousin » l’ustekinumab (UST- Stelara®), à la fois anti-IL-12 et anti-IL-23. Ce dernier est remboursé en Belgique depuis 2017 dans la MC et depuis 2020 dans la RC, mais est utilisé depuis beaucoup plus longtemps pour le psoriasis (2009) ou l’arthrite psoriasique. Tout comme l’UST, le RZB a un excellent profil de sécurité, sans effet secondaire significatif. Le RZB cible la sous-unité p19 de l’IL-23, spécifique à celle-ci à la différence de l’UST qui cible la sous-unité p40 commune aux deux interleukines 12 et 23. C’est cette dernière IL-23 qui apparait comme la plus importante dans la médiation de l’inflammation chronique dans les MICI. L’étude « Sequence », présentée en octobre 2023 au congrès européen de gastro-entérologie, a comparé chez 520 patients, l’UST et le RZB « en face-à face randomisé » dans le traitement de la MC (3). Le RZB s’est révélé plus efficace sur tous les objectifs définis. La rémission clinique à la semaine 24 était obtenue chez près de 59% des patients traités par RZB vs 40.5% par UST ; et le taux de cicatrisation endoscopique était doublé (32% RZB vs 16% UST) à la semaine 48. Ces résultats sont impressionnants d’autant plus qu’il s’agissait de patients avec MC sévère en échec le plus souvent de plusieurs lignes de traitement. Le profil de sécurité des deux traitements était comparable. Le RZB est administré en IV à la dose de 600 mg aux semaines 0, 4 et 8 suivi, à partir de la semaine 12, d’une injection sous-cutanée de 360 mg toutes les 8 semaines en traitement d’entretien. Un autre anti-IL-23, le mirikizumab (Omvoh®) devrait être commercialisé en 2024 dans la RC. Le guselkumab (Tremfya®), anti-IL-23 également, est déjà commercialisé en dermatologie (psoriasis) et poursuit son développement en phase 3 dans les MICI. La classe des anti-IL23 se positionne clairement comme un acteur essentiel du traitement des MICI.
L’UPA est le 3e arrivé dans la famille des inhibiteurs de la Janus kinase pour le traitement de la RC en 2023 (Figure 1) (4). Tout comme le filgotinib (Jyseleca®), il se caractérise par une plus grande sélectivité pour la sous-unité JAK1. Le but est d’obtenir davantage d’efficacité pour moins de potentiels effets secondaires. Ces traitements sont efficaces tant pour l’induction que pour le maintien de la rémission de la maladie. L’UPA est habituellement démarré avec une dose de 45 mg quotidienne pendant 12 semaines puis un relais par 30 voire 15 mg/ jour comme traitement au long cours. Pour rappel un des grands avantages des anti-JAK est leur rapidité d’action permettant de diminuer la durée d’exposition aux corticoïdes et d’amener assez rapidement le patient en rémission. Ils sont remboursés à partir de la deuxième ligne, c’est-à-dire après l’échec d’une première ligne de traitement biologique (anti-TNF ou anti-intégrines). On reste prudent dans leur prescription aux patients, surtout masculins, de plus de 65 ans, tabagiques ou présentant des facteurs de risque cardiovasculaire (risque accru de thrombophlébite, d’embolie pulmonaire, d’incident vasculaire et de néoplasie du poumon). Cette prudence est liée à un signal d’alerte par l’EMA observée pour les anti-JAK non-sélectifs et globalisée pour l’instant à tous les anti-JAK existants. L’UPA est par ailleurs le premier anti-JAK a avoir obtenu son remboursement en Belgique pour la MC (depuis le 1 février 2024), également à partir de la deuxième ligne de traitement (5). Son positionnement attendu sera, certainement dans un premier temps, plutôt en 3e ligne chez la majorité des patients. Cependant son efficacité dans les manifestations extra-intestinales des MICI (notamment rhumatologiques) ainsi que sur des lésions ano-périnéales est à prendre en compte dans le choix du traitement.
Ces avancées thérapeutiques sont essentielles et accroissent nos possibilités de prise en charge dans une population de patients MICI grandissante. On parle d’ailleurs d’une pandémie de MICI et certains prédisent une prévalence des MICI d’un individu sur 100 en 2030 !
Références
- D’Haens G, Panaccione R, Baert F, et al. Risankizumab as induction therapy for Crohn’s disease: results from the phase 3 ADVANCE and MOTIVATE induction trials. The Lancet. 2022;399(10340):2015–30.
- Ferrante M, Panaccione R, Baert F, et al. Risankizumab as maintenance therapy for moderately to severely active Crohn’s disease: results from the multicentre, randomised, double-blind, placebo-controlled, withdrawal phase 3 FORTIFY maintenance trial. The Lancet. 2022;399(10340):2031–46.
- Peyrin-Biroulet L, et al. Risankizumab versus ustekinumab for patients with moderate to severe Crohn’s disease: results from the phase 3b SEQUENCE study. United European Gastroenterol J. 2023;11:919–22 (abstract).
- Danese S, Vermeire S, Zhou W, et al. Upadacitinib as induction and maintenance therapy for moderately to severely active ulcerative colitis: results from three phase 3, multicentre, double-blind, randomised trials. The Lancet. 2022;399(10341):2113–28.
- Loftus E V., Panés J, Lacerda AP, et al. Upadacitinib Induction and Maintenance Therapy for Crohn’s Disease. N Engl J Med. 2023;388(21):1966–80.
Maladie stéatosique du foie : uniformisation de la nomenclature
Nicolas Lanthier, Peter Stärkel
L’année 2023 a vu enfin l’aboutissement d’un consensus sur la terminologie à utiliser pour la maladie stéatosique du foie (1).
Les limitations de l’utilisation des termes NAFLD et NASH (pour « non-alcoholic » fatty liver disease et steatohepatitis) résidaient dans l’application d’un diagnostic d’exclusion alors qu’il s’agit d’une maladie fréquente aisément suspectée par des moyens non-invasifs et des critères cliniques et qui, en pratique courante, peut coexister avec d’autres maladies hépatiques (comme une hépatite virale ou auto-immune) (1). De plus, les termes « non-alcoolique » et « fatty » peuvent être perçus comme stigmatisants dans la société ou peu adaptés à certaines situations (pédiatrie ou « bons vivants ») (1,2). D’un point de vue scientifique, des données récentes ont également mis en évidence le rôle délétère de l’éthanol produit par certaines bactéries du tube digestif de patients obèses ne consommant pas d’alcool. Ces taux d’éthanol atteignant le foie via la veine porte y sont métabolisés et non-mesurables dans le sang périphérique (2). Comme ils peuvent participer à l’atteinte hépatique « métabolique », il ne serait pas logique d’appeler cette atteinte « non-alcoolique » (2).
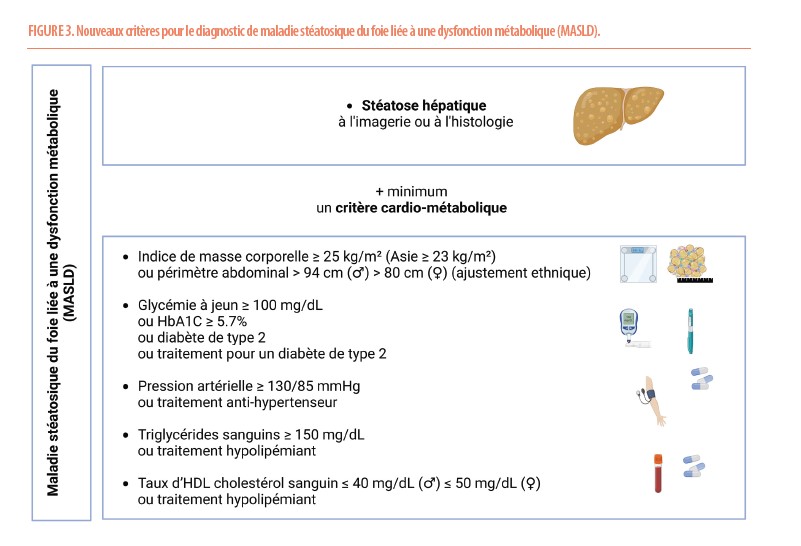
Désormais, une nouvelle nomenclature est proposée (Figure 2). La maladie stéatosique du foie (SLD) peut être suspectée à l’imagerie ou définie histologiquement. Elle peut ensuite être liée à l’alcool (ALD) en cas de consommation importante de boissons alcoolisées (♂ >3 verres/jour, ♀ >2 verres/jour), d’origine mixte (MetALD) en cas de critère cardio-métabolique et d’alcool (♂ 3-6 verres/jour, ♀ 2-5 verres/jour), liée à une dysfonction métabolique (MASLD) en cas de présence d’au-moins un critère cardio-métabolique (Figure 3) ou liée à une étiologie spécifique plus rare (Figure 2).
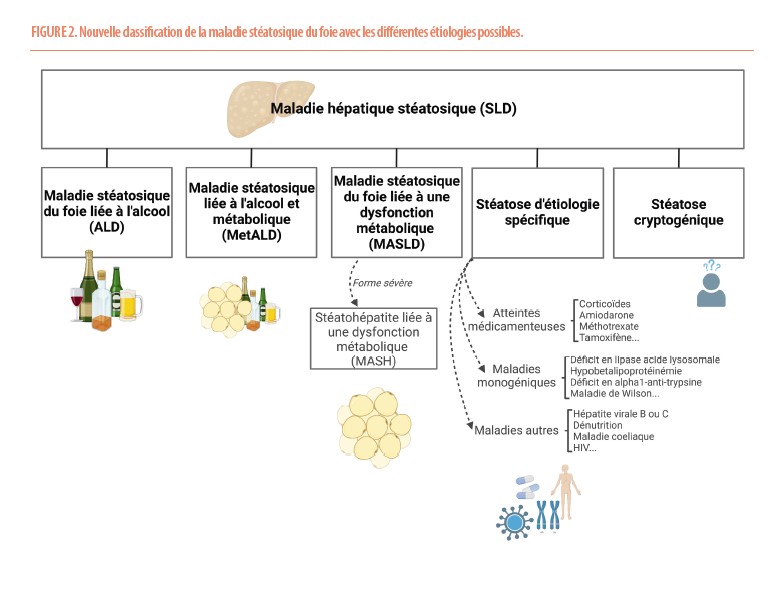
Le groupe MetALD correspond à une réalité qui souligne le risque accru de maladie sévère du foie en cas de co-facteurs qu’il convient d’évaluer (3,4). Les désavantages de cette nouvelle nomenclature sont le fait que les critères cardio-métaboliques (Figure 3) sont très larges. Plus de 90% des individus de plus de 45 ans présentent en effet au-moins un critère cardio-métabolique (5). Ceci surévaluerait par conséquent les patients MetALD et pourrait minimiser le rôle de l’alcool. C’est la raison pour laquelle des personnes avec une lourde consommation d’alcool (♂ ≥7 verres/jour, ♀ ≥6 verres/jour) sont classés dans la catégorie ALD même en présence d’un critère cardio-métabolique. Face à cet algorithme, il est également utile de garder notre esprit critique afin de ne pas restreindre toutes les perturbations de tests hépatiques aux seules MASLD, ALD ou MetALD. Fort heureusement, la médecine ne peut en effet se résoudre à l’application d’arbres décisionnels.
Références
- Rinella ME, Lazarus J V., Ratziu V, et al. A multisociety Delphi consensus statement on new fatty liver disease nomenclature. J Hepatol. 2023;79(6):1542–56.
- Lanthier N, Armstrong MJ. Metabolic steatosis: recent scientific data also support a change in nomenclature. Acta Gastroenterol Belg. 2023;86(1):105–6.
- Binet Q, Loumaye A, Hermans MP, Lanthier N. A Cross-sectional Real-life Study of the Prevalence, Severity, and Determinants of Metabolic Dysfunction-associated Fatty Liver Disease in Type 2 Diabetes Patients. J Clin Transl Hepatol. 2023;11(6).
- Binet Q, Hermans MP, Lanthier N. Screening for NAFLD and its severity in type 2 diabetic patients: Value of magnetic resonance imaging and outstanding issues. J Hepatol. 2023;78(5):e166–7.
- Cusi K, Younossi Z, Roden M. From NAFLD to MASLD: Promise and pitfalls of a new definition. J Hepatol. 2023.
Affiliations
Service d’Hépato-Gastroentérologie, Département de Médecine interne, Cliniques universitaires Saint-Luc, UCLouvain, Bruxelles, Belgique.
Correspondance
Pr. Nicolas Lanthier, MD, PhD
Cliniques universitaires Saint-Luc
Service d’Hépato-Gastroentérologie UCLouvain
Avenue Hippocrate, 10 B-1200 Bruxelles
nicolas.lanthier@saintluc.uclouvain.be