Une nouvelle ère en oncologie : l’avènement des anticorps conjugués et de nouvelles thérapies ciblées
Emmanuel Seront et Cédric Van Marcke
Les anticorps conjugués, un mode de fonctionnement innovant
Un anticorps conjugué (ADC) est un anticorps ciblant une protéine spécifique, couplé chimiquement à plusieurs molécules d’un puissant agent cytotoxique. Ces ADC administrés par voie intraveineuse permettent une délivrance extrêmement ciblée de la chimiothérapie aux cellules cancéreuses par le biais de leur internalisation. De manière schématique, la molécule cytotoxique est inactive tant qu’elle est couplée à l’anticorps. Cet anticorps va identifier les cellules cancéreuses portant la cible spécifique. Le complexe « protéine cible – anticorps » (et conjointement le cytotoxique) sera internalisé dans la cellule tumorale. L’environnement intra-cellulaire entrainera la lyse du lien chimique entre l’anticorps et le cytotoxique, permettant à ce dernier d’exercer son activité. Ceci permet donc d’administrer des doses de chimiothérapie plus puissantes et plus spécifiquement aux cellules tumorales, tout en épargnant au maximum les cellules non-tumorales. Il semble par ailleurs que les cellules tumorales se nécrosant par l’effet de ces traitements relarguent encore les molécules de cytotoxique dans leur environnement immédiat. Ceci permettrait ainsi d’atteindre les cellules tumorales adjacentes n’ayant pas subi le couplage « anticorps – protéine cible » (Figure 1).
De nombreuses nouvelles molécules sont actuellement en cours de développement ou d’étude, mais plusieurs ADC sont actuellement déjà disponibles et remboursés en Belgique : l’Enfortumab Vedotin (EV), qui cible la protéine Nectin-4 et est conjugué au monométhyl auristatine E (MMAE) ; le Sacituzumab Govitecan (SG), qui cible la protéine Trop-2 et est conjugué à un inhibiteur de la topoisomérase 1 (SN-38) ; et la molécule soulevant actuellement le plus d’intérêt, le Trastuzumab Deruxtecan, qui cible la protéine HER2 et est également conjugué à un inhibiteur de la topoisomérase 1 (deruxtecan)
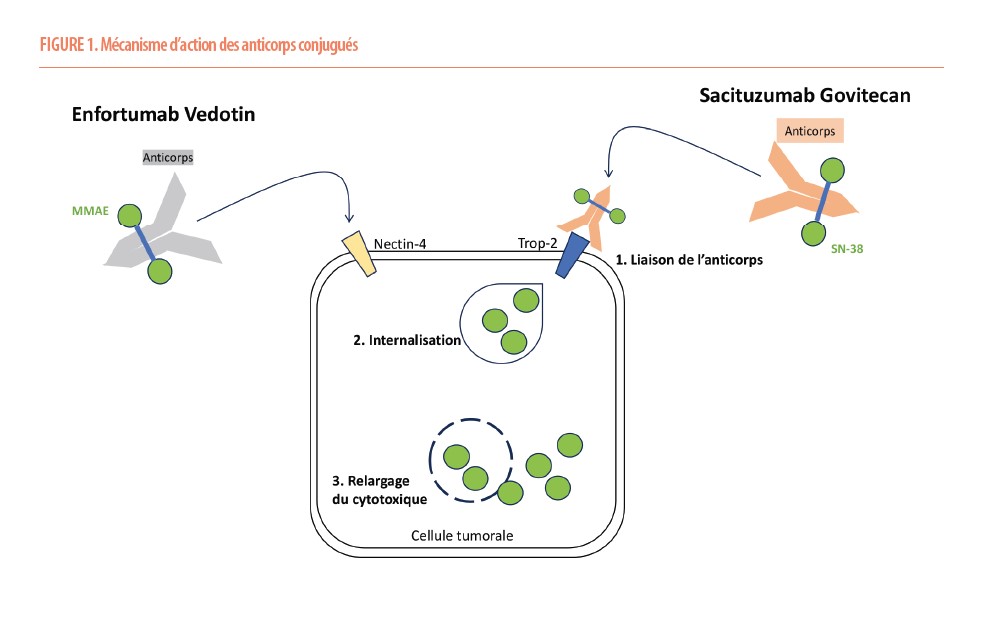
Enfortumab Vedotin dans le carcinome urothélial
Avant 2023, les patients atteints de carcinome urothélial métastatique (CUm) ne pouvaient pas espérer une survie globale médiane dépassant 2 ans. Le traitement de première ligne consistait en une chimiothérapie à base de platine suivi, en cas de réponse ou de stabilité, de l’administration en « maintenance » de l’avelumab, un inhibiteur des checkpoints immunitaires (ICI = immunothérapie). La médiane de survie atteignait grâce à cette stratégie 21 mois. Pour les patients inéligibles à une chimiothérapie, les options étaient plus restreintes, limitées aux ICIs (tels que le Pembrolizumab) ainsi qu’à d’autres chimiothérapie dont l’efficacité restait modérée (1).
Plus de 90% des cellules du carcinome urothélial présentent à leur surface la protéine Nectin-4, ce qui en fait une cible de choix pour l’EV. Lors de l’ESMO 2023, les résultats de l’étude de phase III EV-302/KEYNOTE-A39 ont considérablement changé le pronostic des patients. Dans cette étude, 900 patients atteints d’un CUm en première ligne ont été randomisés pour recevoir soit EV (Jour 1 et 8, cycle de 3 semaines) + Pembrolizumab (P, toutes les 3 semaines), soit une chimiothérapie conventionnelle. La combinaison EV + P a significativement doublé la médiane de survie globale passant de 16 mois dans le bras chimiothérapie à 31.5 mois dans le bras EV + P (HR : 0.47, p<0,00001). Le taux de réponse était également significativement plus élevé avec EV + P par rapport à la chimiothérapie (67.7% vs 44.4%, respectivement), avec une réponse complète plus élevée de 30% vs 12%, respectivement. Seulement 8% des patients dans le bras EV + P présentaient une progression de la maladie : ceci n’a jamais été vu dans ce type de cancer agressif. En termes d’effets secondaires, cette combinaison est associée à un pourcentage moindre d’effets secondaires de grade ≥3 par rapport à la chimiothérapie (56% vs 70%, respectivement). Les principaux effets secondaires liées à l’EV + P incluent une éruption cutanée (principalement localisée au niveau des plis), des neuropathies périphériques sensorielle et un risque de déséquilibre glycémique.
Sur base de ces résultats convaincants, EV + P devient le nouveau standard de soins dans le CUm en première ligne (2). Cette combinaison est sûre, réalisable chez la majorité des patients atteints de CUm (contrairement à la chimiothérapie) et permet de doubler la survie par rapport aux traitements conventionnels. Nous sommes en attente du remboursement de cette combinaison.
Sacituzumab Govitecan dans le cancer du sein triple négatif
Bien que le cancer du sein soit majoritairement diagnostiqué au stade localisé et traité de manière curative, les récidives à un stade plus avancé ou métastatique forment le risque principal. Au stade métastatique, l’approche n’est malheureusement plus curative. Dans le cadre des cancers triple négatifs (n’exprimant ni les récepteurs aux oestrogènes, ni à la progestérone, et ne surexprimant pas la protéine HER2), les chimiothérapies conventionnelles, éventuellement associées à de l’immunothérapie, forment actuellement le socle des traitements. Toutefois, leur efficacité modérée et souvent restreinte dans le temps, requérant le développement de molécules au mode d’action innovant. La majorité des cellules de carcinome mammaire, et singulièrement des tumeurs triple négatives, présentent à leur surface la protéine Trop-2. Ceci fait de ce type de tumeur une cible de choix pour le SG.
L’étude de phase III ASCENT a randomisé 468 patients atteints d’un cancer du sein métastatique triple négatif récidivant ou réfractaire, les assignant soit au sacituzumab govitecan (SG), soit à une chimiothérapie conventionnelle (éribuline, vinorelbine, capécitabine ou gemcitabine). Le SG a significativement amélioré la survie sans progression par rapport à la chimiothérapie (5.6 vs 1.7 mois ; HR 0.41, P<0,001), de même que la survie globale (12.1 vs 6.7 mois ; HR 0.48, P<0,001). Il est à noter un taux de réponse considérablement plus élevé avec le SG par rapport à la chimiothérapie conventionnelle (35% vs 5%), et ce, au sein d’une population de patients ayant déjà reçu de multiples lignes de traitement. Malgré une myélotoxicité plus prononcée (51% de neutropénie de grade≥ 3 avec le SG vs 33% avec la chimiothérapie), le SG demeurait bien toléré compte tenu du nombre de traitements précédemment administrés dans cette population. Le cytotoxique étant un dérivé de l’irinotecan, on sera toujours particulièrement attentif au risque de toxicité digestive, et particulièrement de diarrhée et colite requérant une prise en charge dès les premières heures par mesures symptomatique, hydratation et si besoin antibiothérapie (3). Vu la combinaison d’un risque de neutropénie et de colite, la prévention primaire de la myélotoxicité (par injection sous-cutanée de facteurs de croissance granulocytaire) doit s’appliquer. Ce traitement est disponible et remboursé en cas de cancer du sein triple négatif non résécable, après échec d’une première ligne de chimiothérapie.
Le SG a par ailleurs démontré son intérêt clinique dans un autre type de cancer du sein. L’étude de phase III TROPiCS-02 a évalué le SG chez des patients atteints de cancer du sein exprimant les récepteurs hormonaux mais ne surexprimant pas le récepteur HER2, métastatique, préalablement traités et résistant à l’hormonothérapie. Les patients (n=543) étaient randomisés entre SG et chimiothérapie conventionnelle. Le SG a significativement amélioré la survie globale, passant de 11 mois avec la chimiothérapie à 14.4 mois avec le SG. Le taux de réponse était également plus élevé avec le SG par rapport à la chimiothérapie (21% vs 14%) (4). A ce jour, le SG n’est malheureusement pas encore disponible en Belgique dans cette indication.
Trastuzumab deruxtecan dans le cancer du sein surexprimant HER2
Le cancer du sein surexprimant HER2 se caractérise par une haute densité d’expression de la protéine HER2 à la surface des cellules tumorales. Au stade avancé, il se traite depuis de nombreuses années par une combinaison de chimiothérapie et de thérapie ciblée (molécules ciblant HER2, telles que le trastuzumab et le pertuzumab), avant maintenance par les anti-HER2. Malgré le taux de réponse spectaculaire vu avec ces traitements, une résistance finit par s’installer, nécessitant la reprise de chimiothérapies, combinées si possible à un anti-HER2. Ces lignes successives n’offrent malheureusement pas un taux de réponse identique, voire même satisfaisant.
Le mode d’action révolutionnaire du trastuzumab deruxtecan a révolutionné ces 2 dernières années la stratégie thérapeutique et le pronostic de ce type de cancer du sein. Dans l’étude DESTINY-Breast03, 524 patients atteints de ce type de cancer du sein à un stade avancé, et après échec d’une première ligne de chimiothérapie et d’anti-HER2, étaient randomisés entre le trastuzumab deruxtecan (injection intraveineuse toutes les 3 semaines) et le trastuzumab emtansine (ADC de première génération considéré comme traitement standard dans cette indication depuis 2012, mais aux propriétés pharmacologiques nettement moins spécifiques). Les résultats étaient sans appel : la survie médiane sans progression était de 6.8 mois dans le bras standard, contre 28.8 mois dans le bras expérimental, offrant ainsi une réduction du risque de progression de 67%. La survie globale était également drastiquement améliorée, le risque de décès étant réduit de 36% (5).
Trastuzumab deruxtecan dans une nouvelle entité, le cancer du sein HER2 faible
Les cancers du sein ne surexprimant pas la protéine HER2 peuvent être catégorisés de triple négatives ou d’hormono-dépendantes, selon leur statut d’expression des récepteurs aux hormones. Ces 2 catégories regroupaient jusqu’à présent sans distinction clinique les tumeurs n’exprimant pas du tout la protéine HER2 (dites HER2 zéro), et celles exprimant faiblement la protéine HER2 (dites HER2 1+ ou 2+ sans amplification du gène codant pour HER2). Ces dernières ne bénéficiaient pas des traitements par trastuzumab ni pertuzumab, car la protéine HER2 n’y est pas la cause du développement tumoral. Inhiber la voie de signalisation HER2 n’y a donc pas d’intérêt.
Le mode d’action du trastuzumab deruxtecan a toutefois révolutionné la manière de considérer les cancers du sein exprimant faiblement la protéine HER2. En effet, cet ADC n’a pas pour but d’inhiber la voie HER2, mais d’utiliser la protéine HER2 comme cible pour internaliser un puissant cytotoxique, tel un cheval de Troie.
L’étude DESTINY-Breast04 a démontré l’efficacité de cette molécule en cas de cancer du sein métastatique exprimant faiblement la protéine HER2 (score 1+ ou 2+ sans amplification du gène codant pour HER2), malgré traitement par 1 à 2 lignes de chimiothérapie (6). L’étude a randomisé 557 patients entre le trastuzumab deruxtecan et la chimiothérapie au choix de l’investigateur. L’ADC a permis d’améliorer la survie sans progression de 5.1 mois à 10.1 mois, et la survie globale de 16.8 mois à 23.4 mois. La majorité (89%) de ces patients exprimaient les récepteurs hormonaux, rendant les données actuellement plus robustes dans ces cas.
Cette molécule a ces derniers mois donc non seulement mené à l’obtention d’une arme thérapeutique supplémentaire (le traitement est remboursé en cas de tumeur métastatique surexprimant fortement HER2 après échec d’une première ligne), mais a également permis de bouleverser la classification des cancers du sein. Suite à cela, de nombreuses recherches vont tenter d’affiner la manière de mesurer l’expression de la protéine HER2, pour réduire au mieux le pourcentage de tumeur dite HER2 zéro.
Malgré ces résultats très enthousiasmants, il convient de toujours rester très attentif au risque de toxicité très spécifique de cette molécule. La survenue d’une pneumopathie interstitielle doit être exclue (par réalisation d’un scanner pulmonaire, et non par simple radiographie thoracique) devant toute apparition d’une toux, dyspnée ou autre symptôme de dégradation de l’état général. La gestion de cet effet secondaire (dont le risque cumulé est de l’ordre de 10-15% dans les premières études) mériterait un article à part entière, mais de manière schématique, sa prise en charge sera agressive, avec administration de corticothérapie même en cas de découverte fortuite au scanner en l’absence de toute plainte.
De manière plus conventionnelle, ce traitement peut également fréquemment s’accompagner de fatigue et troubles digestifs, et particulièrement de nausées, qui seront prévenues par combinaison d’anti-émétiques puissants.
Les inhibiteurs HIF dans le cancer du rein
Le cancer du rein est un cancer dont une des particularités est une hyperactivation du processus angiogénique. Physiologiquement, l’angiogenèse est régulée par le gène de Von Hippel-Lindau (VHL), un gène suppresseur de tumeur dont l’activité dépend du degré d’oxygénation tissulaire.
En cas de normoxie, la protéine VHL est active et entraine la dégradation du facteur de transcription Hypoxia-Inducible Factor (HIF-1). En cas d’hypoxie, VHL est inactivée, ce qui permet à HIF-1 de s’hétéro-dimériser avec la sous-unité HIF-2 et de migrer vers le noyau où HIF peut stimuler la transcription de nombreux gènes tels que le VEGF, impliqué dans l’angiogenèse, mais aussi la Cycline D1, le transporteur de glucose GLUT-1 et l’EPO, impliqués dans la prolifération et la survie cellulaire. Plus de 90% des Cancers du rein à cellules claires (ccRCC) présentent une perte du gène VHL, entraînant une angiogenèse excessive. Le belzutifan (médicament oral) est un inhibiteur de la sous-unité 2α de HIF, empêchant ainsi sa translocation vers le noyau et son activité transcriptionnelle (Figure 2).
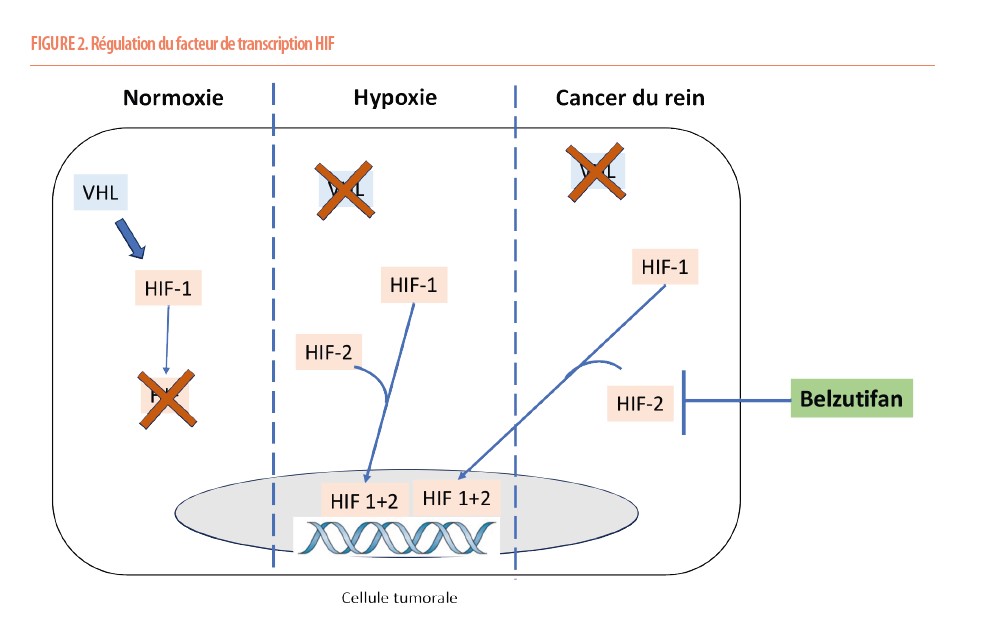
L’étude de phase III LITESPARK-005 a comparé le belzutifan à l’éverolimus chez plus de 700 patients atteints d’un ccRCC avancé après échec de plusieurs lignes de traitement ; ces patients étaient lourdement prétraités et fragiles avec un risque intermédiaire ou défavorable selon les critères IMDC (un indice pronostique du cancer du rein). Le belzutifan a entraîné une réduction de 26% de la progression ou du décès. De plus, le belzutifan était associé à un taux de réponse plus important (22 vs 3%) mais aussi une durée de réponse beaucoup plus longue (19 vs 13 mois) par rapport à l’éverolimus. Enfin, le belzutifan, de par sa bonne tolérance, était également associé à une meilleure qualité de vie par rapport à l’éverolimus. Ce type de molécule, de par son mécanisme d’action innovant, est également associé à un profil d’effet secondaire différent ; en effet, via une inhibition de l’EPO, le belzutifan peut entrainer de l’anémie (30%) mais également de l’hypoxie (10%). Ces effets peuvent facilement être contrôlés par des injections d’EPO. Sur la base de ce profil d’efficacité et de sécurité, le belzutifan apparaît comme une bonne alternative à éverolimus et devrait faire partie de notre arsenal thérapeutique (7).
De nouvelles études incluant ce médicament sont actuellement en cours, comme par exemple l’étude LITESPARK-012, une étude de phase III évaluant l’efficacité l’association de Pembrolizumab et Lenvatinib +/- Belzutifan ou Quavonlimab (un inhibiteur de la protéine 4 associée aux lymphocytes T cytotoxiques).
En conclusion
Le développement de nouvelles molécules, au mécanisme d’action innovant, permet de mettre en place de nouvelles stratégies thérapeutiques, de nouvelles combinaisons et de pallier aux résistances qui peuvent rapidement se développer face aux traitements conventionnels. De nombreuses études sont en cours, testant l’intérêt des ADC dans de grands nombres de types de tumeurs.
La prescription de ce type de traitements nécessite de bien informer le patient, son entourage et le médecin traitant des effets secondaires particuliers pouvant se présenter : leur reconnaissance au stade le plus précoce possible est fondamental.
Messages clés
- Les anticorps conjugués font depuis peu partie de notre arsenal thérapeutique et permettent de significativement améliorer la survie générale, même dans des cancers très agressifs.
- Ces molécules sont généralement bien tolérées mais nécessitent un suivi régulier, car elles peuvent entrainer des toxicités particulières.
- La connaissance de ces toxicités par le médecin traitant peut permettre une prise en charge immédiate, point clé pour une récupération complète.
- Le Belzutifan est un médicament prometteur dans le cancer du rein à cellules claires.
- Plus que jamais, la participation aux études cliniques permet d’avoir un accès à ces molécules, pour certaines, encore indisponibles.
Références
- Powles T, Park SH, Voog E, et al. Avelumab Maintenance Therapy for Advanced or Metastatic Urothelial Carcinoma. N Engl J Med. 2020 Sep 24;383(13):1218-1230
- Powles TB, et al. EV-302/KEYNOTE-A39: Open-label, randomized phase 3 study of enfortumab vedotin in combination with pembrolizumab (EV+P) vs chemotherapy (chemo) in previously untreated locally advanced metastatic urothelial carcinoma (la/mUC). ESMO Congress 2023, LBA6
- Bardia A, Hurvitz SA, Tolaney SM et al. Sacituzumab Govitecan in Metastatic Triple-Negative Breast Cancer. N Engl J Med. 2021; 384(16), 1529–1541.
- Rugo HS, Bardia A, Marmé F, et al. Overall survival with sacituzumab govitecan in hormone receptor-positive and human epidermal growth factor receptor 2-negative metastatic breast cancer (TROPiCS-02): a randomised, open-label, multicentre, phase 3 trial. Lancet. 2023; 402(10411), 1423–1433.
- Hurvitz SA, Hegg R, Chung WP, et al. Trastuzumab deruxtecan versus trastuzumab emtansine in patients with HER2-positive metastatic breast cancer: updated results from DESTINY-Breast03, a randomised, open-label, phase 3 trial. Lancet. 2023 Jan 14;401(10371):105-117. doi: 10.1016/S0140-6736(22)02420-5.
- Modi S, Jacot W, Yamashita T, et al. DESTINY-Breast04 Trial Investigators. Trastuzumab Deruxtecan in Previously Treated HER2-Low Advanced Breast Cancer. N Engl J Med. 2022 Jul 7;387(1):9-20. doi: 10.1056/NEJMoa2203690. Epub 2022 Jun 5. PMID: 35665782; PMCID: PMC10561652.
- Albiges L, Rini BI, Peltola K, et al. LBA88 Belzutifan versus everolimus in participants (pts) with previously treated advanced clear cell renal cell carcinoma (ccRCC): Randomized open-label phase III LITESPARK-005 study. Annals of Oncology. 2023; 34, S1329–S1330.
Des avancées majeures dans le traitement du mélanome uvéal métastatique
Jean-François Baurain, Stéphanie van Raemdonck, Louise Favaretto, Laura Krolikowska, Frank Cornélis, Paulina Bartoszek
Introduction
Le mélanome uvéal est un cancer rare, bien qu’étant la tumeur primitive la plus fréquente de l’oeil. Il combine deux peurs : celles du cancer et de la cécité. Le Registre Belge du Cancer estime qu’environ 120 patients sont diagnostiqués par an avec un pic d’incidence entre 60 et 65 ans. Tout comme le mélanome cutané, le mélanome uvéal provient de la transformation maligne de mélanocytes. Cependant, il se distingue fortement de celui-ci par plusieurs aspects : son profil mutationnel différent (pas de mutations BRAF ou NRAS mais GNAQ ou GNA11), sa charge mutationnelle globale plus basse (+/- 0,5 mutations par mégabase), sa faible expression de PD-L1 et son modèle de dissémination métastatique presqu’exclusivement hépatique. Le traitement de la tumeur primitive oculaire a peu changé ces dernières décennies et est le plus souvent une brachythérapie. Malgré ce dernier, plus d’un tiers des patients vont récidiver au niveau systémique. La survie médiane des patients métastatiques suivant les séries historiques est de 1 an ou moins (1). L’immunothérapie par inhibiteurs des points de contrôle du système immunitaire (ICI) améliore le pronostic des patients métastatiques qui ont une survie globale médiane d’un peu plus de 12 mois (2). Aucune étude randomisée n’a démontré le bénéfice des ICI. Une nouvelle forme d’immunothérapie a révolutionné le pronostic des patients métastatiques HLA-A2. Le tebentafusp est une molécule bispécifique transformant les lymphocytes du patient en lymphocytes anti-mélanome. Ce médicament a démontré, dans le cadre d’une étude randomisée, qu’il améliore la survie des patients métastatiques (3,4).
La tumeur primitive
L’uvée est la couche vasculaire de l’oeil, riche en mélanocytes. Elle comprend l’iris à l’avant, le corps ciliaire dans sa portion intermédiaire, et la choroïde dans sa portion postérieure, située entre la sclère et la rétine. Le mélanome uvéal peut se développer dans n’importe quelle de ces trois localisations avec la fréquence qui diminue de l’arrière de l’oeil vers l’avant. Le diagnostic est posé par un ophtalmologue spécialisé en oncologie oculaire chez un patient référé pour une lésion suspecte. Cette lésion est découverte fortuitement dans un tiers des cas ou suite à des symptômes visuels tels baisse de vision, phosphènes, myodesopsies ou encore métamorphopsies). Le traitement consiste essentiellement en irradiation de la lésion, soit par radiothérapie de contact - brachythérapie, soit par source externe (protons ou gamma knife).
Une biopsie tumorale est rarement nécessaire pour confirmer le diagnostic, mais peut néanmoins être proposée au patient afin d’étudier le risque de métastases sur base du profil tumoral génétique. Par exemple, sur base du profilage de l’expression génétique, deux classes de tumeurs ont pu être identifiées : classe 1 (bas risque) et 2 (haut risque de métastases). Malgré l’efficacité locale d’environ 95%, ce traitement ne prend pas en charge les micrométastases, éventuellement déjà présentes lors du diagnostic.
Le pronostic visuel de l’oeil dépendra d’abord de la localisation de la tumeur. Le traitement de la tumeur proche ou infiltrant les structures nobles, telle macula ou nerf optique, amènera inévitablement des séquelles visuelles. Le pronostic visuel dépend aussi des dimensions de la tumeur. Plus la tumeur est grande, plus la dose de rayons utilisée pour la détruire sera importante et donc nocive pour les structures saines de l’oeil.
Pour les tumeurs trop volumineuses, une énucléation est pratiquée en première intention. On y a recours également en seconde intention s’il y a une récidive intra-oculaire post irradiation ou s’il y a des complications oculaires post-radiques incontrôlables. Indépendamment du choix du traitement local, le patient présente un risque de récidive extra-oculaire et doit bénéficier d’un bilan iconographique du foie et des poumons à la recherche des métastases de manière semestrielle pendant au moins les 5 premières années.
La maladie métastatique
Si le risque de récidive locale est faible après un traitement conservateur de la tumeur primitive, 30 à 50% des patients vont pourtant récidiver à distance. Etant donné que l’uvée ne possède pas de drainage lymphatique, les métastases sont hématogènes. Les facteurs de risque clinique de développer des métastases ont été identifiés : un âge avancé lors du diagnostic initial, une taille importante de la tumeur oculaire, l’atteinte du corps ciliaire et une extension extrasclérale. Il existe aussi des facteurs de risque propres à la tumeur comme son type cellulaire épithéloïde, une perte du chromosome 3 ou une amplification du chromosome 8. Nonante pour cent des patients récidivants auront des lésions hépatiques et pour la grande majorité d’entre eux elles seront exclusivement hépatiques. Il est exceptionnel d’avoir des maladies oligométastatiques. La présence de métastases exclusivement hépatiques est un facteur de mauvais pronostic tandis qu’un bon état général et un taux sérique normal de LDH sont des facteurs de bon pronostic. On estime que moins de 8% des patients sont encore en vie après deux ans.
Les oncologues disposent de trois grandes classes de traitements systémiques contre les cancers : la chimiothérapie, les thérapies ciblées et l’immunothérapie. La chimiothérapie avec des agents alkylants tels que la dacarbazine ou le temozolomide est peu efficace. Moins de 5% des patients répondent et elle ne permet pas d’augmenter la survie de ceux-ci (5). Pour les patients avec exclusivement des lésions hépatiques, la fotemustine qui a un premier passage hépatique élevé a été utilisée comme chimiothérapie intra-artérielle (6). Le melphalan a lui été utilisé dans les perfusions hépatiques isolées (7). Ces deux traitements n’ont pas démontré d’avantage statistiquement significatif par rapport à la chimiothérapie intraveineuse.
Plus de 90% des mélanomes uvéaux ont des mutations dans les gènes codant pour deux phosphatases, GNA11 et GNAQ. Ces protéines mutées vont indirectement activer une des voies majeures de transduction du signal, la voie des MAPKinases (RAS-RAF-MEK-ERK). Dès lors, il était logique de tester des inhibiteurs de cette voie tels que le selumetinib (inhibiteur MEK). Une étude randomisée de phase II n’a pas pu démontrer que cette médication était supérieure à la dacarbazine (8). Un driver majeur de la transformation oncogénique du mélanome uvéal est l’inactivation de BAP1. Cette protéine est l’unité catalytique du complexe de la déubiquitinase PR-DUB qui va déubiquitiner l’histone H2A permettant ainsi l’expression de certains gènes. Il a été montré in vitro que les inhibiteurs des histones déacetylases (HDAC) jouent un rôle important pour le maintien de la fonction de BAP1 et permettent de transformer des mélanomes uvéaux de classe 2 en classe 1, leur conférant ainsi un phénotype moins agressif (9). Des études de phase I sont en cours pour étudier l’efficacité du panobinostat, un inhibiteur pan-HDAC seul ou en combinaison avec des inhibiteurs MEK.
Actuellement, seule l’immunothérapie a permis d’améliorer le pronostic des patients atteints d’un mélanome uvéal métastatique. Les Inhibiteurs des points de Contrôle du système Immunitaire (ICI) ont révolutionné le pronostic de nombreux patients métastatiques atteints de mélanome cutané ou d’autres cancers. Les anticorps bloquant l’axe PD-1/PD-L1 (pembrolizumab ou nivolumab) permettent d’obtenir une réponse chez plus de 40% des patients atteints d’un mélanome cutané métastatique et une survie globale médiane de 36 mois. Malheureusement, l’amplitude du bénéfice est moindre dans le mélanome uvéal métastatique où moins de 5% des patients présentent des réponses et la survie médiane est légèrement supérieure à 12 mois. Les anticorps anti-CTLA-4 (ipilimumab) sont encore moins efficaces, pas de réponse et une survie médiane de 8 mois (10). Dans une étude prospective de phase II, la combinaison de nivolumab et d’ipilimumab permet d’induire une réponse chez 11% des patients et une survie médiane légèrement supérieure à 1 an (11). Bien que l’on ne puisse pas comparer des études entre elles, il semble que la combinaison nivolumab et ipilimumab ne soit pas supérieure en termes de survie globale médiane par rapport à celle observée avec la monothérapie anti-PD-1. Dans une sous-analyse non encore publiée d’une méta-analyse des différentes séries rétrospectives de patients traités par ICI, il semble que les lésions pulmonaires répondent mieux à la double immunothérapie. Nous réservons donc la combinaison qui est plus toxique pour les mélanomes agressifs où une réponse rapide est attendue ainsi que pour les patients avec des métastases pulmonaires.
Le tebentafusp est une nouvelle molécule bispécifique combinant un récepteur T et un anticorps monoclonal. Il reconnaît l’antigène gp100.A2 et le CD3. Le CD3 est un complexe étroitement associé au récepteur T du lymphocyte (TCR) qui va transduire l’activation du TCR à ses partenaires d’aval. Le TCR présent dans le tebentafusp va reconnaître spécifiquement un fragment de la protéine gp100 présenté sur la molécule HLA-A*0201 (Figure 1). La protéine gp100 est impliquée dans la production de la mélanine et est présente dans tous les mélanomes, mais également dans les mélanocytes. Le tebentafusp permet donc de transformer tous les lymphocytes d’un individu en lymphocytes anti mélanome/mélanocyte. Ce médicament est approuvé et remboursé en Belgique depuis le premier novembre 2023 sur base d’une étude randomisée de phase II, l’étude IMCgp100-202, comparant le tebentafusp au traitement de référence (la majorité des patients ont reçu du pembrolizumab). Le tebentafusp ou Kimmtrak® permet d’augmenter de manière significative la survie médiane des patients métastatiques de 16,9 mois dans le bras contrôle à 21,6 mois dans le bras tebentafusp (Figure 2). Cependant, le recul est encore faible pour identifier un sous-groupe de patients qui pourrait bénéficier à long terme du tebentafusp. Le taux de réponse est faible et la survie sans progression est augmentée de manière marginale (deux semaines). Une analyse de biomarqueurs a montré que la disparition de l’ADN tumoral circulant est un gage de bénéfice à long terme. Ce biomarqueur doit être validé dans des études prospectives et n’est malheureusement pas disponible en pratique clinique.
Le tebentafusp est administré de manière hebdomadaire par voie intraveineuse. Lors des premières administrations, il y a un risque de Syndrome de Relarguage des Cytokines (CRS) avec baisse de tension artérielle, nécessitant parfois des manœuvres de soutien hémodynamique avec une prise en charge aux soins intensifs. Dès lors, la première dose est faible (20 μg) et administrée en hospitalisation. L’autre réaction immédiate est un érythème cutané diffus et prurigineux qui est lié à l’afflux massif de lymphocytes transformés au niveau de l’épiderme où siègent les mélanocytes. La dose est progressivement majorée à 30 μg lors de la deuxième injection et 68 μg lors de la troisième injection, avec diminution – dès cette dernière – des effets collatéraux. Les injections suivantes peuvent ainsi être réalisées en ambulatoire. Les seuls effets secondaires observés sur le moyen terme sont une fatigue et une dépigmentation progressive. Globalement, les patients traités ont une excellente qualité de vie.
Une analyse statistique comparant 240 patients traités par tebentafusp, 95 patients traités par pembrolizumab et 45 patients traités par nivolumab et ipilimumab a été réalisée (12). Cette analyse utilise la méthodologie IPTW (propensity score-based inverse proabability of treatment weighting) qui permet de balancer les différences de deux groupes en respectant des covariables de base mimant ainsi une randomisation. Cela nécessite d’avoir les données de patients afin de tenir compte de l’âge, du sexe, du niveau basal de LDH et de phosphatase alcaline, de la localisation de la maladie, de l’état général du patient et du délai entre le diagnostic de la tumeur primaire et de la métastase. La comparaison du tebentafusp avec la combinaison nivolumab et ipilimumab montre que les patients ont respectivement une survie à 1 an de 73% versus de 50%, ce qui est statistiquement significatif : HR=0,52 (0,35-0,78). Par contre il n’y a pas de différence statistiquement significative entre le pembrolizumab et la combinaison nivolumab et ipilimumab avec une survie médiane de 16,9 mois versus de 14,2 mois respectivement, HR=0,72 (0,5-1,06).
Conclusion
Le mélanome uvéal est un cancer rare. Le diagnostic précoce et la prise en charge rapide dans des centres hautement spécialisés sont un gage de meilleur pronostic pour le patient. Le type de traitement de la tumeur primitive, énucléation ou brachythérapie, n’influence pas le risque de récidive extra-oculaire qui est élevé. Il est ainsi indispensable de réaliser un suivi hépato-pulmonaire régulier afin de détecter le plus précocement les rares formes de maladies oligométastatiques. Ces dernières vont bénéficier d’une sanction chirurgicale ou d’une radiothérapie ciblée qui va améliorer significativement leur pronostic de vie. La survie médiane d’un patient récidivant sans traitement est inférieure à un an. Si la maladie métastatique est diffuse, le scénario le plus fréquent, il faut faire un typage HLA. Pour les patients qui sont HLA-A2, ils doivent recevoir en première intention du tebentafusp. Les autres patients recevront une immunothérapie avec des anticorps anti-PD-1. La combinaison nivolumab et ipilimumab ne sera administrée que chez les patients pour lesquels une réponse rapide est souhaitée et qui peuvent tolérer la toxicité éventuelle ou ceux présentant des métastases pulmonaires.
Take Home Messages
1. Le mélanome uvéal est un cancer rare qui doit être pris en charge dans des centres spécialisés reconnus tels que l’Institut Roi Albert II, CUSL, UCLouvain.
2. Le mélanome uvéal est différent du mélanome cutané au niveau génétique, clinique, pronostic et de son traitement.
3. Entre un tiers et la moitié des patients vont récidiver, pour la grande majorité au niveau hépatique), malgré un traitement optimal de leur tumeur primitive oculaire, suite à la dissémination tumorale préalable.
4. Les rares maladies oligométastatiques doivent bénéficier d’un traitement ciblé tel que la chirurgie, la radiothérapie ou la thermoablation.
5. L’immunothérapie par anticorps anti-PD1 est le traitement de la maladie métastatique. Cependant les patients qui sont HLA-A2 doivent recevoir un nouveau traitement, le tebentafusp, qui est plus efficace et moins toxique.
6. Afin d’améliorer le pronostic de ces patients, il faut encore réaliser de nombreuses recherches fondamentales et cliniques, notamment sur le traitement adjuvant des micrométastases.
Références
- Khoja L, Atenafu EG, Suciu S, Leyvraz S, Sato T, Marshall E et al. Meta-analysis in metastatic uveal melanoma to determine progression free and overall survival benchmarks: an international rare cancers initiative (IRCI) ocular melanoma study. Ann Oncol. 2019 Aug 1;30(8):1370-1380
- Wessely A, Steeb T, Erdmann M, Heinzerling L, Vera J, Schlaak M, et al. The Role of Immune Checkpoint Blockade in Uveal Melanoma. Int J Mol Sci. 2020 Jan 29;21(3):879.
- Nathan P, Hassel JC, Rutkowski P, Baurain JF, Butler MO, Schlaak M, et al. Overall Survival Benefit with Tebentafusp in Metastatic Uveal Melanoma. N Engl J Med. 2021 Sep 23;385(13):1196-1206.
- Hassel JC, Piperno-Neumann S, Rutkowski P, Baurain JF, Schlaak M, Butler MO, et al. Three-Year Overall Survival with Tebentafusp in Metastatic Uveal Melanoma.N Engl J Med. 2023 Dec 14;389(24):2256-2266.
- Rantala ES, Hernberg M, Kivelä TT. Overall survival after treatment for metastatic uveal melanoma: a systematic review and meta-analysis. Melanoma Res. 2019 Dec;29(6):561-568.
- Leyvraz S, Piperno-Neumann S, Suciu S, Baurain JF, Zdzienicki M, Testori A, et al. Hepatic intra-arterial versus intravenous fotemustine in patients with liver metastases from uveal melanoma (EORTC 18021): a multicentric randomized trial. Ann Oncol. 2014 Mar;25(3):742-746.
- Huibers A, DePalo DK, Perez MC, Zager JS, Olofsson Bagge R. Isolated hyperthermic perfusions for cutaneous melanoma in-transit metastasis of the limb and uveal melanoma metastasis to the liver. Clin Exp Metastasis. 2023 Oct 16.
- Carvajal RD, Piperno-Neumann S, Kapiteijn E, Chapman PB, Frank S, Joshua AM, et al. Selumetinib in Combination With Dacarbazine in Patients With Metastatic Uveal Melanoma: A Phase III, Multicenter, Randomized Trial (SUMIT). J Clin Oncol. 2018 Apr 20;36(12):1232-1239.
- Faião-Flores F, Smalley KS. Histone deacetylase inhibitors: a promising partner for MEK inhibitors in uveal melanoma? Melanoma Manag. 2019 Dec 16;6(4):MMT29.
- Maio M, Danielli R, Chiarion-Sileni V, Pigozzo J, Parmiani G, Ridolfi R, et al. Efficacy and safety of ipilimumab in patients with pre-treated, uveal melanoma. Ann Oncol. 2013 Nov;24(11):2911-5.
- Piulats JM, Espinosa E, de la Cruz Merino L, Varela M, Alonso Carrión L, Martín-Algarra S, et al. Nivolumab Plus Ipilimumab for Treatment-Naïve Metastatic Uveal Melanoma: An Open-Label, Multicenter, Phase II Trial by the Spanish Multidisciplinary Melanoma Group (GEM-1402). J Clin Oncol. 2021 Feb 20;39(6):586-598.
- Piulats JM, Watkins C, Costa-García M, Del Carpio L, Piperno-Neumann S, Rutkowski P, et al. Overall survival from tebentafusp versus nivolumab plus ipilimumab in first-line metastatic uveal melanoma: a propensity score-weighted analysis. Ann Oncol. 2023 Dec 2:S0923-7534(23)05100-1.
Affiliations
1. Service d’Oncologie Médicale, Cliniques universitaires Saint-Luc, Université catholique de Louvain
2. Institut Roi Albert II, Cliniques universitaires Saint-Luc
3. MIRO, IREC, Université catholique de Louvain
4. Service d’Ophtalmologie, Cliniques universitaires Saint-Luc, Université catholique de Louvain
Correspondance
Dr Emmanuel Seront
Dr Jean-François Baurain
Cliniques universitaires Saint-Luc
Oncologie Médicale
Avenue Hippocrate 10
B-1200 Bruxelles